Опухоли могут заставлять соседние клетки поддерживать рост рака, выделяя лактат в окружающую среду, утверждают исследователи из Weill Cornell Medicine.
Полученные результаты открывают путь для создания в будущем лекарственных препаратов, которые будут препятствовать этому защитному механизму, чтобы помочь больным раком.
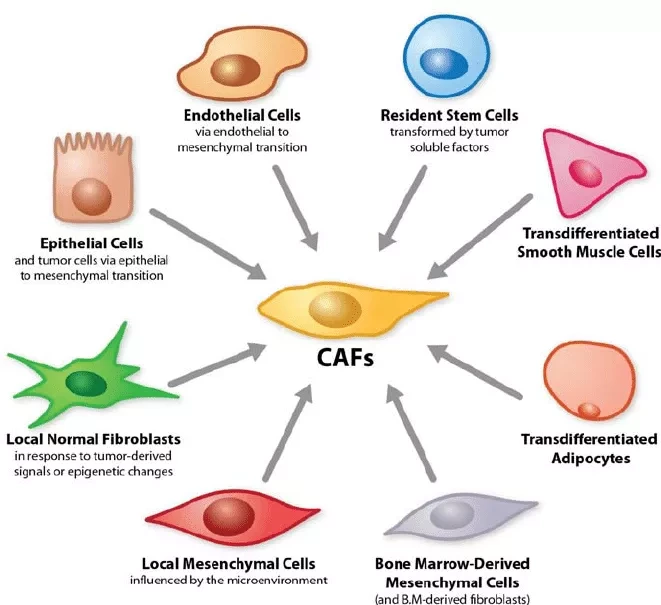
В исследовании, опубликованном в журнале Cell Reports, ученые определили, как опухоли по мере своего развития привлекают близлежащие фибробласты для работы в качестве помощников. Фибробласты являются частью "стромы", или соединительной ткани органов, и обычно выполняют важные восстановительные и поддерживающие функции. Но раково-ассоциированные фибробласты (CAFs) приобретают свойства, позволяющие им помогать опухолям таким образом, что опухоли становятся более злокачественными и их труднее уничтожить.
Исследователи также обнаружили, что широко используемые противораковые препараты, называемые ингибиторами PARP-1, имитируют один из ключевых этапов привлечения CAF, и поэтому часто могут снижать собственную эффективность, переводя местные фибробласты в режим, способствующий развитию рака. "Будущие препараты, блокирующие это раково-ассоциированное состояние фибробластов, могут быть полезны сами по себе или как способ повышения эффективности ингибиторов PARP-1", - говорит соавтор исследования Мария Диас-Меко, профессор онкологии в Weill Cornell Medicine.
Ученые уже несколько десятилетий знают, что развивающиеся опухоли часто изменяют свое местное окружение таким образом, чтобы способствовать своему выживанию и росту. Раково-ассоциированные фибробласты являются центральным компонентом опухолевой микросреды при раке простаты, легких, толстой кишки и многих других видах рака. Поэтому воздействие на эти клетки рассматривается как многообещающий дополнительный подход к стандартному лечению рака, который может работать очень широко против рака различного клеточного и генетического происхождения.
"Раково-ассоциированные фибробласты поддерживают рост опухоли, поставляя факторы роста и необходимые метаболиты в опухоль, противостоя противоопухолевым иммунным клеткам и многими другими способами", - говорит Диас-Меко. "В результате опухоль становится более злокачественной и устойчивой к лечению".
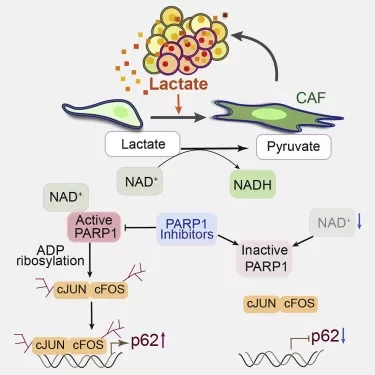
Лаборатория Диас-Меко несколько лет назад обнаружила, что белок p62, вырабатываемый фибробластами, обычно подавляет CAF, хотя многие опухоли находят способ восстановить это состояние путем снижения выработки p62 фибробластами. В новом исследовании было показано, что опухоли достигают этого путем выделения высокого уровня лактата (молочной кислоты). Лактат является нормальным побочным продуктом определенных процессов производства энергии в клетках - процессов, которые часто гиперактивны в опухолях.
В экспериментах с клетками рака простаты исследователи подробно описали молекулярную цепь событий, в результате которых выделяемый опухолью лактат нарушает нормальный метаболизм фибробластов, что приводит к снижению активности гена p62 и активации благоприятного для опухоли состояния CAF. Само по себе это открытие важно, поскольку оно освещает основной путь, способствующий развитию рака, на который в принципе могут быть направлены будущие препараты в качестве самостоятельной или дополнительной стратегии лечения.
Но есть и второе, неожиданное открытие. Оказалось, что ключевой шаг, ведущий от выделения опухолью лактата к подавлению p62 фибробластами, заключается в ингибировании фермента восстановления ДНК под названием PARP1. Класс противораковых препаратов, называемых ингибиторами PARP1, обладает тем же эффектом - что позволяет предположить, что эти препараты могут частично работать против самих себя, создавая более благоприятную для опухоли микросреду. Исследователи подтвердили на раковых клетках и мышиных моделях, что ингибитор PARP1 олапариб действительно снижает уровень p62 в фибробластах и переводит их в состояние CAF, что, в свою очередь, делает опухоли более устойчивыми к основному убивающему рак действию препарата.
Таким образом, подчеркивают исследователи, будущие методы лечения, которые перепрограммируют клетки CAF в нераковое состояние или предотвратят их развитие, могут значительно повысить противоопухолевую эффективность ингибиторов PARP1. "Сейчас мы изучаем несколько потенциальных препаратов, блокирующих CAF, в нашей лаборатории", - сказала Диас-Меко.
Juan F. Linares et al. Ось лактат-NAD+ активирует раково-ассоциированные фибробласты путем даунрегуляции p62 (аннотация).
Снижение уровня p62 связано с индукцией фенотипа раково-ассоциированных фибробластов (CAF), которые способствуют опухолеобразованию in vitro и in vivo посредством воспаления и метаболического перепрограммирования. Однако вопрос о том, как p62 снижается в строме фибробластов опухолевыми клетками для активации CAF, остается нерешенным.
В данном исследовании мы показали, что выделяемый опухолью лактат снижает транскрипционный уровень p62 через механизм, включающий снижение соотношения NAD+/NADH, что нарушает активность поли(ADP-рибоза)-полимеразы 1 (PARP-1). Ингибирование PARP-1 блокирует поли(ADP-рибозил)ацию факторов транскрипции AP-1, c-FOS и c-JUN, что является обязательным этапом для даунрегуляции p62. Важно отметить, что восстановление уровня p62 в CAFs с помощью NAD+ делает CAFs менее активными. Ингибиторы PARP, такие как олапариб, имитируют лактат в снижении уровня стромального p62, а также последующей стромальной активации как in vitro, так и in vivo, что позволяет предположить, что терапия с использованием олапариба выиграет от стратегий, направленных на подавление активности CAF.