В недавнем исследовании, опубликованном в журнале Nature Aging, ученые характеризуют влияние нейронального аполипопротеина E4 (APOE4) на патологию, ассоциированную с болезнью Альцгеймера (БА), у мышей с тауопатией, экспрессирующих APOE4.
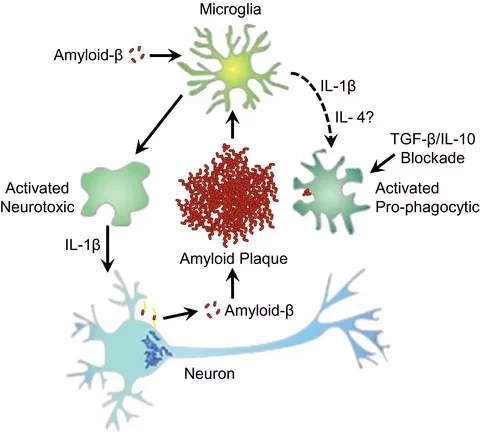
APOE4 является сильным генетическим фактором, повышающим риск развития поздней стадии БА. Стресс и повреждение тканей вызывают экспрессию APOE в нейронах. Предыдущие исследования показали, что нейронный APOE4 имеет решающее значение для процессов, ассоциированных с БА, таких как потеря тормозных нейронов и памяти, а также фосфорилирование белков тау. Однако данные о роли нейронального APOE4 в развитии полномасштабной патофизиологии болезни Альцгеймера ограничены. Выяснение точного вклада нейронального APOE4 в патогенез БА может улучшить понимание специфических механизмов клеточного происхождения, вызывающих эффекты APOE4, и, вероятно, определить новые мишени для разработки антиAPOE4 терапии.
В настоящем исследовании ученые оценили влияние селективного удаления APOE4 из нейронов на патофизиологические механизмы БА, включая глиоз, нейродегенерацию, тау-ассоциированную патологию, неврологическую дисфункцию и дефицит миелина. Флоксированные мыши APOE4-KI (fE) были скрещены с мышами PS19, которые использовались в качестве мышиных моделей тауопатии, а для анализа использовались гибридные мыши PS19-fE/нейрон-специфический промотор синапсина-1 (Syn1-Cre) или PS19-fE.
Для количественной оценки экспрессии APOE4 человека в организме мышей, лизаты гиппокампа мышей анализировали с помощью иммуноферментного анализа. Далее было проведено секвенирование рибонуклеиновых кислот в отдельных ядрах (snRNA-seq). Десятимесячные мыши были иммуноокрашены p-tau-специфическим антителом AT8, чтобы определить, влияет ли элиминация APOE в нейронах на патологию тау. Нейрофибриллярные клубочки оценивали с помощью окрашивания тиофлавином S (Thio-S), а для определения экспрессии AT8+ p-tau в мышином гиппокампе после последовательного выделения высокорастворимых и менее растворимых белков тау проводили вестерн-блот анализ.
Адено-ассоциированный вирус-2 (AAV2), кодирующий мутантный белок тау человека P301S (AAV2-tau-P301S), вводили в ткани гиппокампа 10-месячных fE-мышей, и анализировали распространение тау с инъецированной на неинъецированную сторону. Сома-положительные тау-содержащие нейроны без инъекции были подсчитаны для оценки распространения тау по нейронам, а нейроны с инъекцией были иммуноокрашены человеческим антителом к тау HT7. Анализировались объемы заднебокового желудочка и гиппокампа, а также количественно оценивалась потеря нейронов в различных областях гиппокампа.
Клетки были иммуноокрашены на ядерный белок нейронов (NeuN) и расщепленную каспазу-3 для выявления постмитотических нейронов гиппокампа, подвергающихся апоптозу. Кроме того, был проведен анализ иммуноокрашивания основного белка миелина (MBP), клеток-предшественников олигодендроцитов (OPCs) и анти-Olig2. Была измерена возбудимость нейронной сети в гиппокампальном участке cornu ammonis-1 (CA-1) у мышей PS19-fE4 и PS19-fE3. Оценивались астроглиоз и микроглиоз, проводился дифференциальный анализ экспрессии генов и дифференциальный анализ путей.
Селективное удаление APOE4 из нейронов привело к значительному снижению патологии тау, глиоза, нейродегенерации, повышенной возбудимости нейронов и дефицита миелина. Удаление APOE4 из нейронов значительно уменьшило связанные с нейродегенеративным заболеванием субпопуляции нейронов, олигодендроцитов, астроцитов и микроглии, накопление которых коррелировало с тяжестью патологии тау, нейродегенерации и дефицита миелина.
У мышей PS19-fE4/Syn1-Cre экспрессия APOE4 была снижена на 20% по сравнению с PS19-fE4, что указывает на то, что нейронный APOE4 составляет 20-30% от общей экспрессии APOE4 в тканях коры и гиппокампа. Аналогичным образом, PS19-fE3/Syn1-Cre мышиные животные продемонстрировали снижение экспрессии APOE4 на 25% по сравнению с PS19-fE3 аналогами. У животных PS19-fE4/Syn1-Cre тауопатия была снижена на 81% по сравнению с моделью PS19-fE4. Устранение нейронального APOE4 привело к значительному снижению количества клеток нейрофибриллярных клубочков (NFT ) в тканях гиппокампа у мышей PS19-fE4 по сравнению с их аналогами S19-fE3. PS19-fE3 и PS19-fE4/Syn1-Cre мышиные животные демонстрировали значительно сниженные уровни менее растворимого белка p-tau.
Эти результаты показывают, что нейронный APOE4, вероятно, влияет на экспрессию тау, способствуя агрегации, распространению и фосфорилированию тау, и что нейронный APOE4 сильно повлиял на развитие тау-ассоциированных патологий. Иммуноокрашивание флуоресцентным белком (GFP) показало локализацию GFP в нейронах гиппокампа. APOE4 в нейронах способствовал развитию патологии тау, стимулируя распространение тау и/или р-тау между взаимосвязанными областями мозга. APOE4 в нейронах способствовал апоптозу постмитотических нейронов и приводил к дисфункции нейронов в контексте таупатии. И наоборот, удаление APOE4 из нейронов защищало от тау-опосредованной нейродегенерации и смягчало потерю объема гиппокампа и нейронов.
Ключевая роль нейронального APOE4 заключается в истощении олигодендроцитов и OPCs гиппокампа, что приводит к дефициту миелина. Устранение нейронального APOE4 снижало экспрессию маркерных генов нейронов, ассоциированных с болезнью (nE4-DA), в то время как нейрональный APOE4 стимулировал ассоциированные с болезнью субпопуляции олигодендроцитов, нейронов, дендритов, микроглии и астроцитов. Напротив, кластеры нейронов, олигодендроциты, астроциты и микроглия были обогащены защищающими от заболевания субпопуляциями. Степень микроглиоза и астроглиоза была снижена при удалении APOE4 из нейронов.
В целом, результаты исследования показали, что нейронный APOE4 способствует развитию патологий БА. Таким образом, удаление APOE4 из нейронов может смягчить прогрессирующие нейродегенеративные изменения, происходящие в модели патологии тау, вызванной APOE4, на клеточном и тканевом уровне.
Koutsodendris, N., Blumenfeld, J., Agrawal, A. et al. Удаление APOE4 из нейронов защищает от тау-опосредованного глиоза, нейродегенерации и дефицита миелина (аннотация).
Аполипопротеин Е4 (APOE4) является самым сильным из известных генетических факторов риска развития поздней стадии болезни Альцгеймера (БА). Условия стресса или травмы вызывают экспрессию APOE в нейронах, но роль нейронального APOE4 в патогенезе БА остается неясной.
В данном исследовании мы описываем влияние нейронального APOE4 на патологии, связанные с БА, на мышиной модели тауопатии, экспрессирующей APOE4. Селективное генетическое удаление APOE4 из нейронов привело к значительному уменьшению патологии тау, глиоза, нейродегенерации, повышенной возбудимости нейронов и дефицита миелина. Секвенирование РНК в отдельных ядрах показало, что удаление APOE4 из нейронов значительно уменьшило связанные с нейродегенеративным заболеванием субпопуляции нейронов, олигодендроцитов, астроцитов и микроглии, накопление которых коррелировало с тяжестью патологии тау, нейродегенерации и дефицита миелина.
Таким образом, нейронный APOE4 играет центральную роль в развитии основных патологий БА, и его удаление может смягчить прогрессирующие клеточные и тканевые изменения, происходящие в этой модели тауопатии, вызванной APOE4.