Исследование позволило определить роль фибробластов - клеток, способствующих формированию тканей, - в способности опухоли вырабатывать устойчивость к наиболее распространенному лечению HER2 рака молочных желез.
Работа, опубликованная в журнале Nature Communications, демонстрирует способность новой терапии, проходящей в настоящее время клинические испытания, стимулировать мощный иммунный ответ путем связывания с фибробластами, что позволяет ей преодолевать устойчивость к анти-HER2 терапии в опухолях с этим механизмом защиты раковых клеток. Чтобы продемонстрировать это, исследователи создали трехмерную модель опухоли, в которой они смогли проверить взаимосвязь между всеми задействованными факторами.
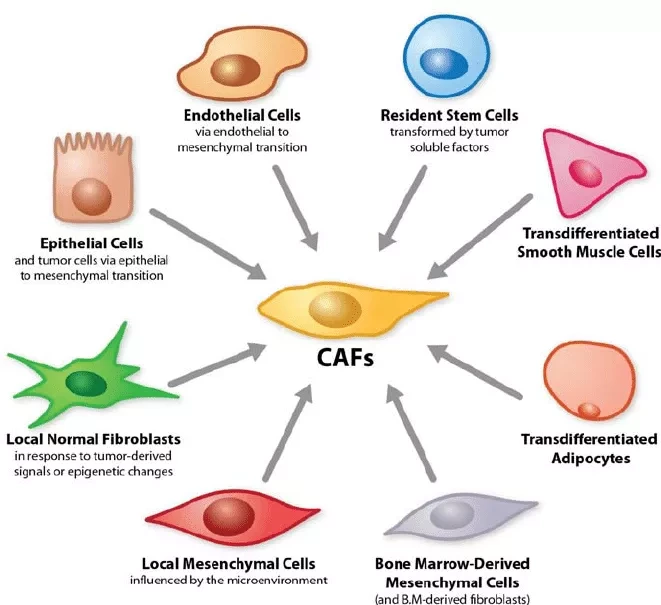
HER2+ рак молочной железы является одним из самых агрессивных и быстро прогрессирующих видов рака. Лечение, направленное на HER2, изменило прогноз, но резистентность продолжает препятствовать потенциальному лечению. Микросреда, окружающая опухоли при раке груди HER2+, защищает их и помогает им развивать устойчивость к наиболее широко применяемому лечению - моноклональным антителам трастузумабу. Ключевую роль в этом процессе играет особый тип клеток этого микроокружения - фибробласты. Эти клетки обладают способностью блокировать иммунную систему и тем самым защищать опухоль. Нахождение способа преодоления этой проблемы повышает способность лечения убивать опухолевые клетки.
В частности, именно наличие активированных TGF-бета фибробластов, которые экспрессируют молекулу под названием FAP, защищает опухоль от действия иммунных клеток. Трастузумаб способен воздействовать на раковые клетки с высоким содержанием белка HER2, и когда он связывается с раковыми клетками, он активирует сильный иммунный ответ, что в значительной степени определяет его эффективность против опухоли. Однако при многих опухолях иммунная система не в состоянии пробиться через микросреду, окружающую опухоль, чтобы уничтожить ее. Это приводит к устойчивости к лечению и увеличивает способность данного типа рака уклоняться от действия лекарства и пролиферировать дальше. Этот механизм был обнаружен группой исследователей из Научно-исследовательского медицинского института госпиталя дель Мар (IMIM-Hospital del Mar).
Авторы также определили способ преодолеть способность опухоли к самозащите и позволить иммунной системе действовать на опухолевые клетки. Используя модель ex vivo, то есть модель, включающую живые клетки больных раком молочной железы, исследователи показали, что, воздействуя иммунотерапией на молекулы FAP, экспрессируемые фибробластами, можно обратить вспять эту способность препятствовать доступу иммунных клеток. "Когда эта молекула, FAP-IL2v, добавляется в воссозданную ex vivo опухоль, содержащую это устойчивое к лечению микроокружение, в контакте с иммунными клетками, эффективность трастузумаба восстанавливается", - утверждает Александр Калон, старший автор исследования и руководитель лаборатории трансляционных исследований микроокружения опухоли в IMIM-Hospital del Mar. Следует отметить, что созданная модель использует человеческие клетки и применима также к другим типам опухолей.
Результаты исследования были подтверждены тремя когортами пациентов и более чем 120 образцами. Во всех из них было обнаружено, что уровень активации фибробластов напрямую связан со способностью иммунной системы воздействовать на опухоль. Чем выше эти уровни, тем сложнее получить доступ к опухолевым клеткам и уничтожить их, несмотря на действие трастузумаба. Калон подчеркнул, что это способствует лучшему отбору пациентов, которым будет полезна терапия FAP-IL2v, направленная на деактивацию действия опухолевого микроокружения. "Если мы отфильтруем людей по этим характеристикам, мы сможем выделить популяцию резистентных к лечению пациентов, на которых можно будет воздействовать этой молекулой, чтобы восстановить эффективность терапии рака молочной железы", - отметил он.
Уже существуют препараты, которые могут быть использованы для достижения этого эффекта, хотя для оценки их применения у пациентов необходимо провести дополнительные исследования, как отмечает Джоан Альбанелл, заведующий отделением онкологии в Госпитале дель Мар и соавтор исследования. "Исследование выявляет опухоли, в которых устойчивость к анти-HER2 терапии вызвана в первую очередь одним типом фибробластов, а не другими причинами. Это важное открытие должно быть использовано для разработки клинических испытаний препаратов, преодолевающих эту резистентность, только для тех пациентов, у которых эта резистентность носит оперативный характер. Именно здесь мы должны двигаться в направлении прецизионной онкологии", - добавляет Альбанелл.
Rivas, E.I., et al. Таргетная иммунотерапия против отдельных раково-ассоциированных фибробластов преодолевает устойчивость к лечению в рефрактерных HER2+ опухолях молочной железы (аннотация).
Около 50% больных раком молочной железы с рецептором эпидермального фактора роста человека 2 (HER2)+ не получают пользы от HER2-таргетной терапии, и почти у 20% из них после лечения происходит рецидив.
В данном исследовании мы проводим детальный анализ двух независимых когорт больных HER2+ раком молочной железы, получавших трастузумаб, чтобы выяснить механизмы резистентности к анти-HER2 моноклональным антителам. Кроме того, мы разработали полностью гуманизированную иммунокомпетентную модель HER2+ рака молочной железы, воспроизводящую ex vivo биологические процессы, которые связаны с ответом пациентов на лечение. Благодаря этим двум подходам мы обнаружили популяцию TGF-beta-активированных раково-ассоциированных фибробластов (CAF), специфичных для опухолей, устойчивых к терапии. Присутствие этой клеточной популяции, связанной с ранее описанными миофибробластическим (CAF-S1) и подопланин+ подтипами CAF при раке молочной железы, ассоциируется с низкой активностью IL2. Соответственно, мы обнаружили, что направленная на строму стимуляция IL2-пути в невосприимчивых опухолях восстанавливает противораковую эффективность трастузумаба.
В целом, наше исследование подчеркивает терапевтический потенциал использования микроокружения опухоли для выявления и преодоления механизмов резистентности к противораковому лечению.