Изменения в метаболических процессах являются отличительной чертой рака и могут привести к образованию кислой среды в опухоли.
В результате раковые клетки должны адаптироваться, чтобы выжить в этой негостеприимной среде. В новом исследовании, опубликованном в журнале Cell Reports, ученые Онкологического центра Моффитта показали, что раковые клетки в кислой среде синтезируют и накапливают липиды. Авторы определили ключевые сигнальные молекулы, ответственные за эти изменения, и обнаружили, что эти изменения связаны с плохим исходом и прогрессированием заболевания у пациенток с раком молочной железы.
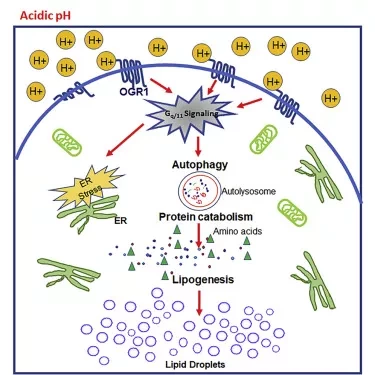
Раковые клетки претерпевают многочисленные изменения, которые способствуют выживанию клеток и их дальнейшему росту. Одним из отличительных изменений раковых клеток является усиленное расщепление глюкозы, что в сочетании с плохим кровоснабжением приводит к развитию крайне кислой среды окружающей опухоль. Чтобы выжить в этой среде, раковые клетки проходят адаптацию, такую как активация процесса саморазрушения и переработки, называемого аутофагией, и накопление липидных капель. Липидные капли играют важную роль в регуляции энергии, метаболизма и передачи сигналов; однако ученые не знают, как они накапливаются в опухолевых клетках и каково их влияние на существование и прогрессирование рака.
Исследователи провели серию лабораторных экспериментов с клеточными линиями и мышиными моделями, чтобы улучшить свое понимание роли липидных капель в развитии рака. Они обнаружили, что линии раковых клеток молочной железы, выращенные в кислых условиях, накапливают внутриклеточные липидные капли, которые экспрессируют белок-биомаркер липидных капель PLIN2. Липидные капли образовывались, когда белок в клеточной мембране под названием OGR1 воспринимал воздействие кислой среды. Затем OGR1 активировал передачу сигнала через белки фосфолипазу С и PI3K/AKT, что приводило к образованию липидных капель из продуктов аминокислот, подвергшихся метаболическому расщеплению на более мелкие компоненты.
Далее специалисты решили оценить биологическое воздействие липидных капель и OGR1 на рак. Оказалось, что рецептор кислотного сенсинга OGR1 высоко экспрессируется в опухолях молочной железы и в значительной степени связан с прогрессированием заболевания. Они продемонстрировали, что, воздействуя на OGR1, можно снизить уровень липидных капель, подавить стрессовые реакции и рост клеток в кислой среде, а также уменьшить рост опухоли у мышей. Кроме того, исследователи обнаружили, что высокая экспрессия биомаркера липидных капель PLIN2 связана с более коротким сроком выживания и прогрессированием заболевания у больных раком молочной железы. Эти совокупные данные свидетельствуют о том, что образование липидных капель, опосредованное OGR1, вносит важный вклад в развитие опухоли и может быть потенциальной мишенью для противораковых препаратов.
"Недавние исследования показали, что перепрограммирование липидного обмена является новым отличительным признаком многих видов рака, что открывает возможности для терапевтического воздействия. Многие ингибиторы липидного метаболизма исследуются в качестве противораковых препаратов в клинических испытаниях. Наши исследования обеспечивают прочную основу для будущих исследований, которые приведут к более подробной характеристике роли OGR1 в ответе на кислотный стресс, аутофагии и липогенезе в животных моделях и опухолях молочной железы человека", - объясняет Смита Пиллай, ведущий автор исследования и научный сотрудник отдела физиологии рака в центре Моффитта.
Smitha Pillai et al. Липогенез, опосредованный OGR1, регулирует метаболическую адаптацию к кислотному стрессу в раковых клетках через аутофагию (аннотация).
Злокачественные опухоли демонстрируют измененный метаболизм, приводящий к высококислому внеклеточному микроокружению. В данном исследовании мы показали, что накопление цитоплазматических липидных капель (LD), свидетельствующее о липогенном фенотипе, является клеточной адаптацией к внеклеточной кислотности. Маркер LD PLIN2 достоверно ассоциируется с низкой общей выживаемостью у больных раком молочной железы. Индуцированное кислотой накопление LD запускается активацией кислоточувствительного G-протеин-связанного рецептора (GPCR) OGR1, который высоко экспрессируется в опухолях молочной железы. Истощение OGR1 подавляет индуцированное кислотой накопление липидов, в то время как активация синтетическим агонистом запускает образование LD. Ингибирование нисходящей сигнализации OGR1 отменяет липогенный фенотип, который может быть восстановлен эктопической экспрессией OGR1. Клетки, лишенные OGR1, демонстрируют торможение роста в кислых условиях in vitro и образование опухолей in vivo. Изотопный анализ показывает, что источником предшественников липидов являются в основном кетогенные аминокислоты, образующиеся в результате аутофагии. Клетки, лишенные OGR1, дефектны в реакции стресса эндоплазматического ретикулума и аутофагии и, следовательно, не накапливают LDs, влияющие на выживание в условиях кислотного стресса.