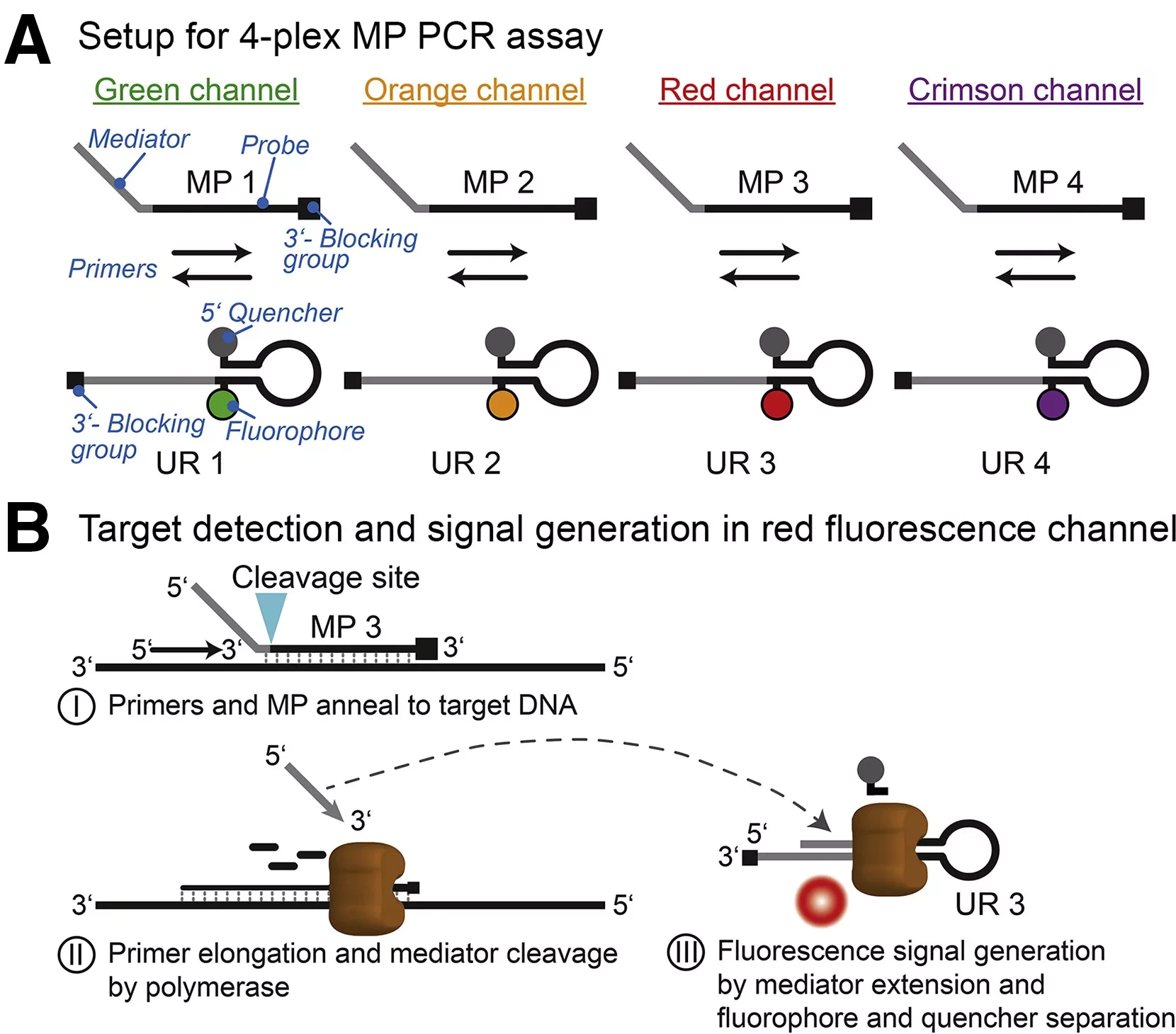
В недавнем исследовании, опубликованном в журнале Nature Communications, ученые использовали данные о сиквенсах РНК, чтобы понять связь между воспалительными цитокинами и плохим исходом педиатрического острого миелоидного лейкоза (pAML).
Детский острый миелоидный лейкоз является гетерогенным заболеванием с различными подтипами, основанными на генетических, клинических, транскрипционных и эпигеномных факторах. Разработка терапии, направленной на клинические исходы каждого из этих подтипов, является сложной задачей. Нацеливание на дисрегуляторные пути, общие для различных подтипов pAML с плохим исходом, может помочь сделать методы лечения более экономически эффективными.
Провоспалительные цитокиновые сигнальные пути, такие как пути интерлейкина (IL)-6, связаны с различными видами рака, причем IL-6 и IL-3 в синергии усиливают пролиферацию гемопоэтических стволовых клеток, а плохие исходы взрослого и детского АМL связаны с высоким уровнем IL-6 в костном мозге. При AML у взрослых IL-6 также повышает регуляцию сигнального пути Янус-киназа (JAK)-сигнальный трансдуктор и активатор транскрипции (STAT) в стволовых клетках и предшественниках клеток крови. Лечение ингибиторами пути JAK/STAT или антителами, нейтрализующими IL-6, показало хорошие результаты при AML у взрослых. Понимание роли сигналов IL-6 в pAML и ассоциации IL-6 с подтипами pAML с плохими клиническими исходами может способствовать разработке широких целевых терапий для различных подтипов.
В настоящем исследовании ученые отобрали образцы костного мозга примерно у 1500 пациентов, включенных в детскую онкологическую группу с диагнозом рАМL. Была выделена общая РНК, и данные последовательности суммарной РНК были сравнены с данными, выделенными из здоровых контрольных образцов с нормальным костным мозгом. Затем исследователи провели анализ обогащения набора генов, чтобы понять сигнальные пути, связанные с высоким уровнем IL-6 в определенных группах пациентов. Полученные результаты были подтверждены с помощью ранее опубликованных данных о последовательностях РНК костного мозга из независимой когорты. Также были проанализированы иммунологические, генетические, демографические и транскриптомные профили пациентов, экспрессирующих высокий уровень IL-6 и рецепторов IL-6.
Клетки костного мозга пациентов с рАМL, экспрессирующие высокий уровень IL-6 и рецепторов IL-6, культивировали в стромальных клетках костного мозга человека (клетки HS-5), которые воспроизводят паттерны экспрессии стромальных клеток костного мозга, такие как секреция IL-6, IL-1β, лиганда для рецепторной протеин-тирозинкиназы (KIT) и макрофагов/гранулоцитарных колониестимулирующих факторов M-CSF, G-CSF и GM-CSF. Клетки костного мозга культивировали в присутствии и в отсутствие руксолитинуба, который ингибирует JAK1/2 и сигналы различных интерферонов (IFN), фактора некроза опухоли-альфа (TNF-α), IL-6 и GM-CSF. Медиаторы цитокиновой сигнализации были проанализированы с помощью метода времяпролетной цитометрии (CyTOF).
Кроме того, с помощью парного дифференциального анализа экспрессии были проанализированы гены, по-разному экспрессирующиеся в костном мозге пациентов с рАМL с высоким уровнем IL-6 и низким уровнем IL-6, а также в нормальном костном мозге здоровых контрольных групп.
Результаты показали, что более 20% пациентов с pAML имели высокий уровень IL-6 и более высокую сигнальную активность воспалительных цитокинов, таких как TNF-α, IFNα и IFNβ, а также IL-1. Эти высокие уровни воспалительных цитокинов и сигнальной активности были также связаны с плохими исходами, такими как более низкая вероятность двухлетней выживаемости без событий и общей выживаемости.
Корректировка на возраст и цитогенные подтипы в группе с высоким уровнем IL-6 не улучшила двух- и пятилетнюю общую выживаемость, что указывает на то, что плохие исходы и ответ на лечение были опосредованы факторами, не связанными с цитогенетикой и возрастом. Кроме того, анализ CyTOF показал, что различные геномные подтипы pAML с высоким уровнем IL-6 и рецептора IL-6 имеют общие механизмы рецептор-опосредованной воспалительной сигнализации. В других исследованиях у взрослых пациентов с AML также были обнаружены сходные закономерности повышения уровня GM-CSF, IL-6 и IL-1.
Целевое секвенирование выявило пять повторяющихся регионов соматических мутаций, включая различные транслокации и перестройки, которые активировали общие сигнальные пути STAT-опосредованной сигнальной трансдукции и фосфоинозитид-3-киназы (PI3K). Геномные подтипы, связанные с этими соматическими мутациями, также показали активацию ядерного фактора каппа-лайт-цепь-энхансера активированных В-клеток (NF-κB). Независимо от геномного подтипа, высокие уровни IL-6 и рецептора IL-6 были связаны с активацией JAK/STAT, NF-κB, внеклеточной киназы 1/2 (ERK1/2) и PI3K, а ингибирование JAK1/2 руксолитинубом in vitro привело к снижению рецептор-опосредованной сигнализации воспалительных цитокинов.
В целом, результаты показали, что высокие уровни IL-6 и рецептора IL-6 у пациентов с рАМL ассоциируются с генетическими подтипами, основанными на пяти соматических мутациях. Однако, независимо от подтипа, у пациентов с рАМL с высоким уровнем IL-6 наблюдалось повышение сигнальных путей воспалительных цитокинов и активация путей JAK/STAT, NF-κB, ERK1/2 и PI3K. Терапия, включающая ингибиторы этих совместно активированных путей, может принести пользу пациентам с рАМL с высоким уровнем IL-6 за счет снижения воспалительных цитокиновых сигнальных путей во всех генетических подтипах.
Bolouri, H., Ries, R.E., Wiedeman, A.E. et al. Воспалительная сигнализация костного мозга при детском остром миелоидном лейкозе дифференцирует пациентов с плохим исходом (аннотация).
Высокий уровень воспалительных цитокинов IL-6 в костном мозге ассоциируется с плохим исходом при детском остром миелоидном лейкозе (pAML), но его этиология остается неизвестной.
Используя данные RNA-seq из костного мозга до лечения 1489 детей с ОМЛ, мы показали, что > 20% пациентов имеют одновременную сигнальную активность IL-6, IL-1, IFNα/β и TNFα и худший исход. Целевое секвенирование образцов костного мозга, взятых до лечения у пациентов (n = 181), выявило 5 высокорецидивирующих моделей соматических мутаций. Используя анализ дифференциальной экспрессии наиболее распространенных геномных подтипов (~60% от общего числа), мы выявили высокую экспрессию нескольких потенциальных факторов, вызывающих резистентность к лечению, связанную с воспалением. Независимо от геномного подтипа, мы показали, что ингибирование JAK1/2 снижает опосредованную рецепторами воспалительную сигнализацию лейкемических клеток in-vitro. Большое количество геномных подтипов pAML с высоким риском представляет собой препятствие для разработки мутационно-специфических методов лечения.
Полученные нами результаты позволяют предположить, что терапия, направленная на воспалительную сигнализацию, может быть эффективной при нескольких геномных подтипах рАМL.