Кембриджские исследователи обнаружили, как Т-клетки - важный компонент нашей иммунной системы - способны продолжать убивать, выслеживая и уничтожая раковые клетки, многократно перезаряжая свое токсичное оружие.
Цитотоксические Т-клетки - это специализированные клетки, которые обучены нашей иммунной системой распознавать и уничтожать угрозы - включая опухолевые клетки и клетки, инфицированные вторгающимися вирусами, такими как SARS-CoV-2. Они также лежат в основе новых иммунотерапий, которые обещают изменить лечение рака.
Профессор Джиллиан Гриффитс из Кембриджского института медицинских исследований, возглавлявшая исследование, говорит: "Т-клетки - это обученные убийцы, которых иммунная система отправляет на смертельные задания. В нашей крови их миллиарды, и каждый из них участвует в жестокой и неустанной борьбе за наше здоровье". "Как только Т-клетки находят свою цель, они связываются с ней и высвобождают свой токсичный груз. Но особенно удивительно то, что затем они способны убивать и убивать снова. Только сейчас, благодаря современным технологиям, мы смогли выяснить, как они перезаряжают свое оружие".
В исследовании, опубликованном в журнале Science, группа ученых показала, что заправка токсичного оружия Т-клеток регулируется митохондриями. Митохондрии часто называют батарейками клетки, так как они обеспечивают энергию для ее функционирования. Однако в данном случае митохондрии используют совершенно иной механизм, чтобы обеспечить Т-киллеров достаточным количеством "боеприпасов" для уничтожения своих целей.
Профессор Гриффитс добавляет: "Этим убийцам необходимо пополнять свой токсичный заряд, чтобы они могли продолжать убивать, не повреждая самих себя. Оказалось, что этот тщательный баланс регулируется митохондриями в Т-клетках, которые устанавливают темп уничтожения в зависимости от того, как быстро они сами могут производить белки. Это позволяет Т-киллерам оставаться здоровыми и продолжать убивать в сложных условиях, когда требуется продолжительная реакция".
Lisci, M et al. Для устойчивого уничтожения цитотоксическими Т-клетками требуется митохондриальная трансляция (аннотация).
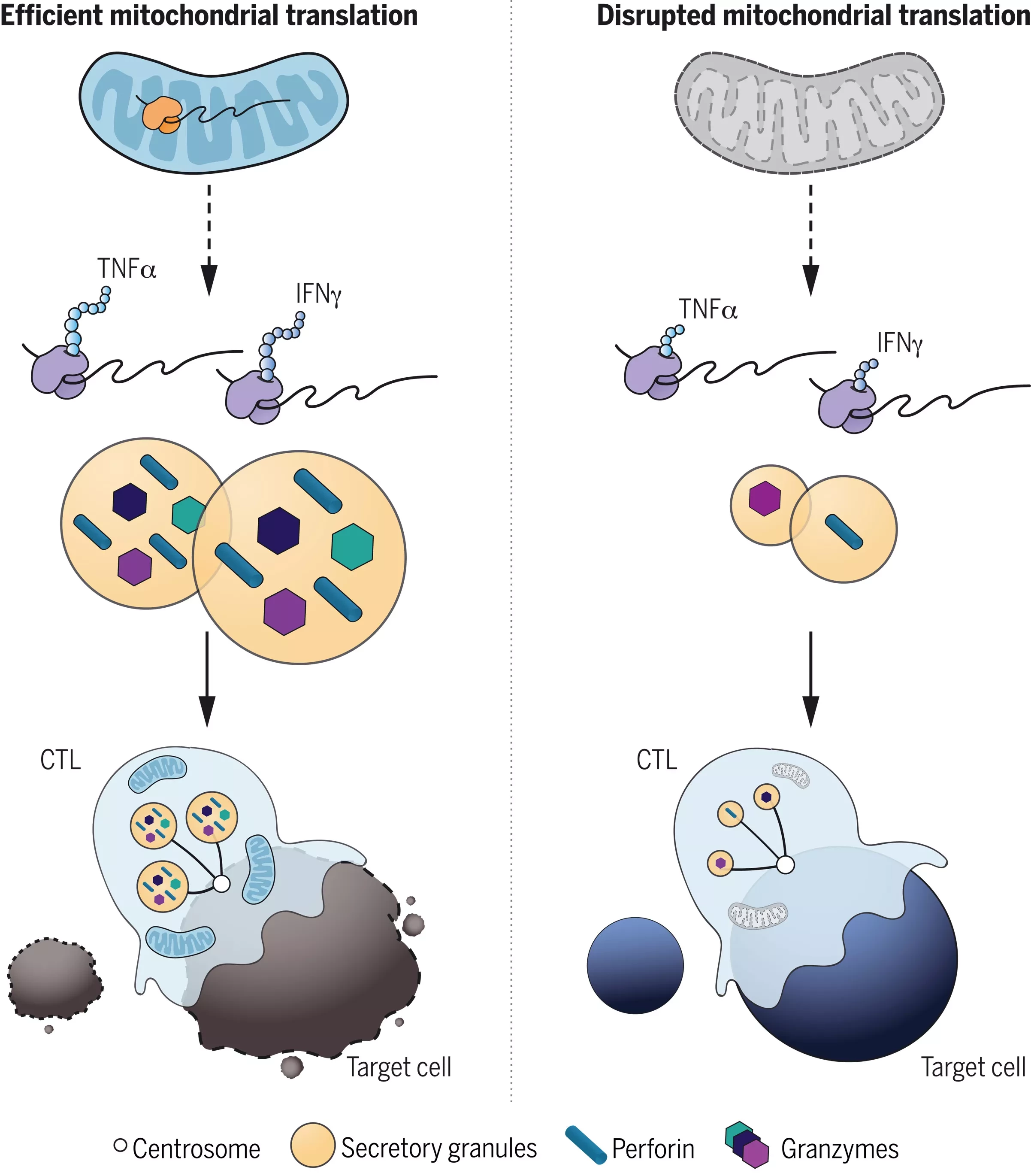
Цитотоксические Т-лимфоциты (CTL) - важные клетки иммунной системы, способные распознавать и уничтожать раковые и вирусные инфицированные клетки. Убийство опосредовано высвобождением специализированных цитолитических белков, включая перфорин и гранзим B, из секреторных гранул. Одна из особенностей, которая делает CTL особенно эффективными убийцами, заключается в их способности осуществлять длительное серийное уничтожение, когда одна CTL атакует несколько целей, одну за другой. Хотя масса митохондрий коррелирует с противоопухолевой активностью CTL, CTL демонстрируют повышенную зависимость от гликолиза, что говорит о снижении зависимости от митохондриального дыхания. Вопрос о том, как, каким образом или почему митохондрии вносят свой вклад в процесс поиска, распознавания и уничтожения CTL, остается не до конца понятным.
USP30 (убиквитин-карбоксил-терминальная гидролаза 30), деубиквитиназа, которая, как известно, ингибирует митофагию, была идентифицирована как регулятор киллинга CTL в широкомасштабном скрининге мышей с удалением одного гена. Эти результаты позволили предположить, что митохондрии могут играть ранее не оцененную роль в биологии CTL. Таким образом, мы сгенерировали CTL от мышей с дефицитом USP30, чтобы изучить природу этого дефекта и понять, как он влияет на киллинг.
Результаты
Развитие Т-клеток у мышей с дефицитом USP30 не нарушалось. Однако при активации CD8+ Т-клетки генерировали CTL с острой потерей митохондрий и нарушением киллинга. Цитотоксичность USP30-дефицитных CTL уменьшалась со временем, что указывает на дефект в устойчивом киллинге. Несмотря на потерю митохондрий и снижение окислительного фосфорилирования в Usp30-/- CTLs, подвижность, сигнализация и секреция, которые необходимы для киллинга, не пострадали. Однако мы обнаружили, что размер секреторных гранул в CTLs Usp30-/- был уменьшен, при этом уменьшилось количество вновь синтезированных промежуточных продуктов ключевых цитолитических белков, перфорина и гранзима В. Это указывает на дефект в синтезе белка de novo, который, как мы показали, необходим для устойчивого киллинга.
Мониторинг трансляции выявил заметное снижение синтеза белка в CTLs Usp30-/-. Используя масс-спектрометрию, чтобы выяснить, влияет ли дефект трансляции на все белки в равной степени, мы обнаружили, что он затрагивает только подмножество цитозольных белков, включая ключевые медиаторы киллингового ответа [гранзим B, перфорин, цитокины фактор некроза опухоли-α (TNF-α) и интерферон-γ (IFN-γ)]. Для поддержания цитотоксичности CTL не требовалось эффективного окислительного фосфорилирования. Однако селективное ингибирование митохондриальной трансляции доксициклином или хлорамфениколом ослабляло трансляцию цитолитических белков, что указывает на существенную роль митохондриальной трансляции в устойчивом киллинге CTL.
Как митохондриальная трансляция может избирательно влиять на трансляцию цитолитических белков и регулировать киллинговую способность CTL? Ни сигнализация mTOR (механистическая мишень рапамицина), ни активация интегрированного стрессового ответа не привели к потере цитозольной трансляции и киллингу у CTLs Usp30-/-. Однако экспрессия метаболических ферментов, которые могут работать как РНК-связывающие белки (RBPs), была изменена как в CTL, лишенных USP30, так и в CTL, обработанных доксициклином. Таким образом, наши результаты позволяют предположить, что посттранскрипционная регуляция RBPs, хорошо описанное явление в CTLs, может опосредовать избирательное снижение регуляции синтеза белка, обнаруженное при потере USP30.
Заключение
Наше исследование подчеркивает роль митохондрий как гомеостатических регуляторов киллинга CTL, при этом производство новых цитолитических белков синхронизировано с митохондриальной трансляцией. Таким образом, энергетические потребности синтеза белка могут быть точно отрегулированы для удовлетворения потребностей серийного киллинга во время иммунных вызовов.