Главный регулятор развития клеток, вырабатывающих антитела, был идентифицирован в ходе исследования, проведенного учеными из Weill Cornell Medicine.
Результаты исследования, опубликованные в журнале Nature Immunology дают новое представление о внутренней работе иммунной системы и могут помочь понять, как развиваются ткани и как возникают некоторые виды рака. Исследование объединило компьютерный анализ с передовыми молекулярно-биологическими и геномными методами, чтобы идентифицировать белок Oct2 как ключевую детерминанту гуморального иммунного ответа В-клеток.
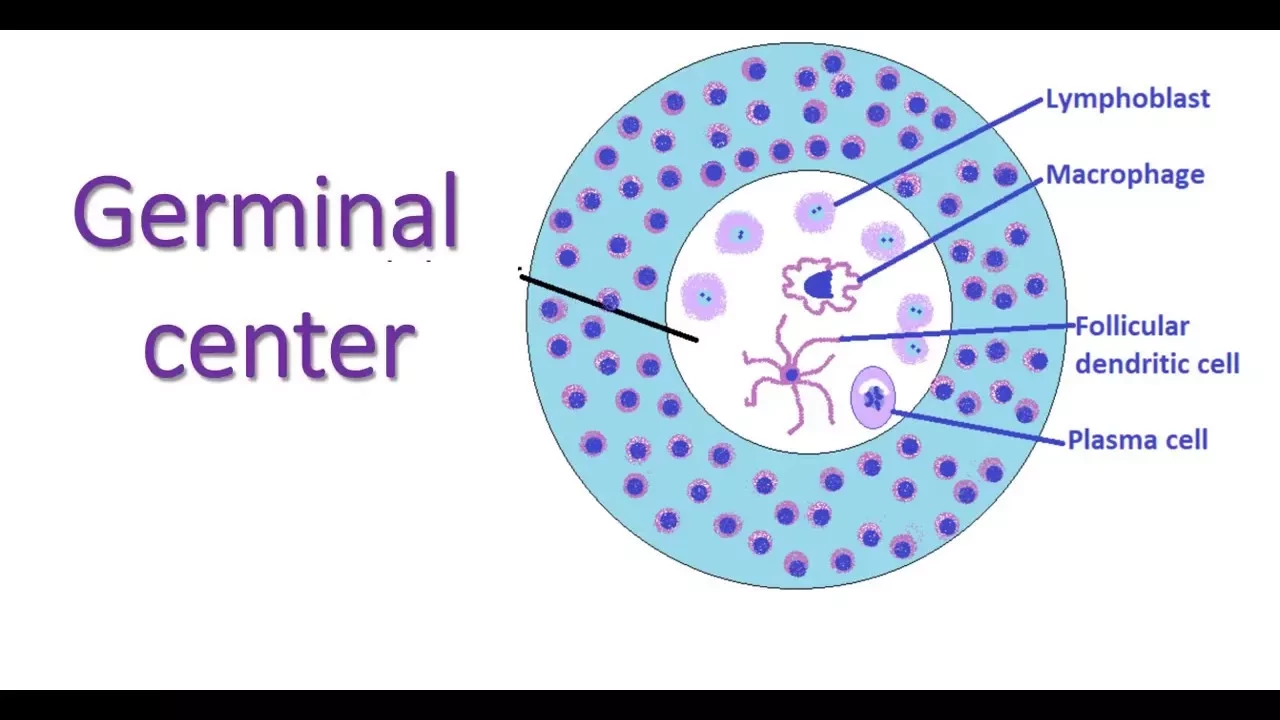
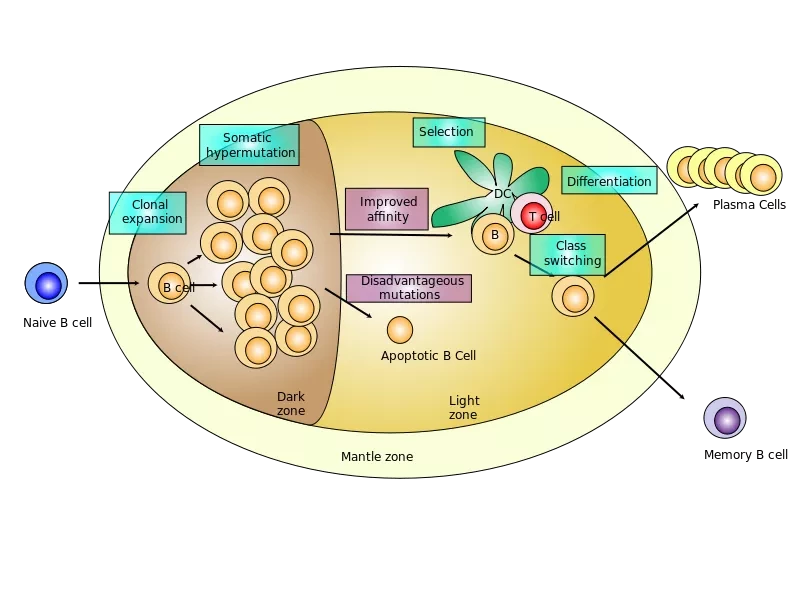
Во время инфекции или после вакцинации зрелые В-клетки образуют герминальные центры, своего рода тренировочный центр. Там клетки мутируют и перестраивают свои гены, кодирующие антитела, до тех пор, пока они либо не произведут улучшенное антитело, либо не погибнут. Этот процесс играет центральную роль в реакции организма на многие патогены, но он также чреват опасностью: неудачные мутации В-клеток могут вызвать рак лимфоидной ткани. "Все наши клетки имеют защитные механизмы против мутирования, но В-клетки делают все наоборот; они специализируются на мутировании, и делают это очень быстро", - говорит соавтор исследования Ари Мельник.
Предыдущие исследования показали, что В-клетки контролируют созревание своего герминального центра, изменяя доступность различных частей своего генома и запуская каскады изменений экспрессии генов для направления и ограничения своего развития. Но что координирует все эти сигналы? Чтобы ответить на этот вопрос исследователи сначала применили компьютерный подход, составив карту всех изменений в регуляции генов, которым подвергаются созревающие В-клетки. "Мы начали с создания атласа всех регуляторных элементов, которые появляются и исчезают в течение определенного периода времени", - рассказывает Мельник. Разработав новые вычислительные методы, команда смогла деконволютировать изменения и идентифицировать OCT2 как молекулу, которая, как оказалось, лежит в основе этого процесса.
Но распределение OCT2 в герминальных центрах оказалось удивительно похожим на его распределение в зрелых В-клетках до их активации. Исследуя В-клетки с помощью новых геномных и молекулярных инструментов в лаборатории, исследователи обнаружили OCT2 в незрелых В-клетках, предварительно размещенный в местах генома, где он позже будет работать во время реакции герминального центра. Другой генный регуляторный белок, OCA-B, активирует геномные участки, помеченные OCT2, превращая их в "супер-энхансеры", которые управляют остальной сетью регуляции созревания В-клеток. "Судьба клетки в некотором смысле предопределена, так что если она получит правильный сигнал, то будет знать, как создать В-клетку герминального центра", - отмечает Мельник.
Понятие клеточного предназначения - и выявление его конкретного механизма - может быть самым значительным открытием в этой работе.
"Я думаю, что это потенциально глубокое открытие, которое может быть применимо ко многим различным переходам между типами клеток", - сказал соавтор исследования Оливье Элементо, директор Института точной медицины. Во время эмбрионального развития, например, одна клетка делится и превращается во все клетки целостного организма, следуя ряду разветвленных точек принятия решений, которые могут использовать аналогичные механизмы для маркировки супер-энхансеров для последующей активации. Нацеливание на главные регуляторы, такие как OCT2 и OCA-B, или их аналоги в других типах клеток, также может дать новый мощный способ борьбы с раком.
"Очень часто можно увидеть, что если ген действительно важен с точки зрения поддержания ракового состояния, то этот ген, как правило, регулируется супер-энхансером", - отметил Элементо. "Раковые клетки полагаются на них как на способ поддержания своей идентичности". Нарушая способность опухолевых клеток формировать критические клеточные типы, специфические супер-энхансеры, можно эффективно вырвать ковер из-под их ног, отключив всю их стратегию выживания.
Doane, A.S. et al. Предварительное позиционирование OCT2 способствует изменению клеточной судьбы и архитектуры хроматина в гуморальном иммунитете (аннотация).
Во время реакции герминального центра (GC) В-клетки подвергаются глубоким транскрипционным, эпигенетическим и геномным архитектурным изменениям. Как происходят такие изменения, остается неизвестным. Сопоставив доступность хроматина во время гуморального иммунного ответа, мы показали, что OCT2 является доминирующим транскрипционным фактором, связанным с дифференциальной доступностью регуляторных элементов GC. Молчащие участки хроматина, которым суждено стать GC-специфическими супер-энхансерами (SEs), содержали предварительно размещенные сайты связывания OCT2 в наивных B-клетках (NBs).
Эти предварительно загруженные "семена" SE характеризовались пространственной кластеризацией регуляторных элементов, обогащенных ДНК-связывающими мотивами OCT2, которые становились сильно загруженными OCT2 и его специфическим для GC коактиватором OCAB в GC B-клетках (GCBs). SEs с высоким содержанием предварительно позиционированного OCT2 связывания предпочтительно формировали дальние хроматиновые контакты в GCs, чтобы поддержать экспрессию GC-специфических факторов. Повышение доступности и архитектурной интерактивности этих регионов зависело от рекрутирования OCAB. Предварительное размещение ключевых регуляторов в SEs может представлять собой широко используемую стратегию для содействия быстрым изменениям клеточной судьбы.