Исследование на мышах идентифицирует фермент TBK1 как важный для определения судьбы В-клеток.
Специалисты из Японии идентифицировали фундаментальную часть долговременной памяти иммунной системы, предоставив новую полезную деталь для разработки лучших вакцин против заболеваний, начиная от COVID-19 и заканчивая малярией. Исследование, опубликованное в Journal of Experimental Medicine, раскрывает новую роль фермента TBK1 в определении судьбы В-клеток памяти иммунной системы.
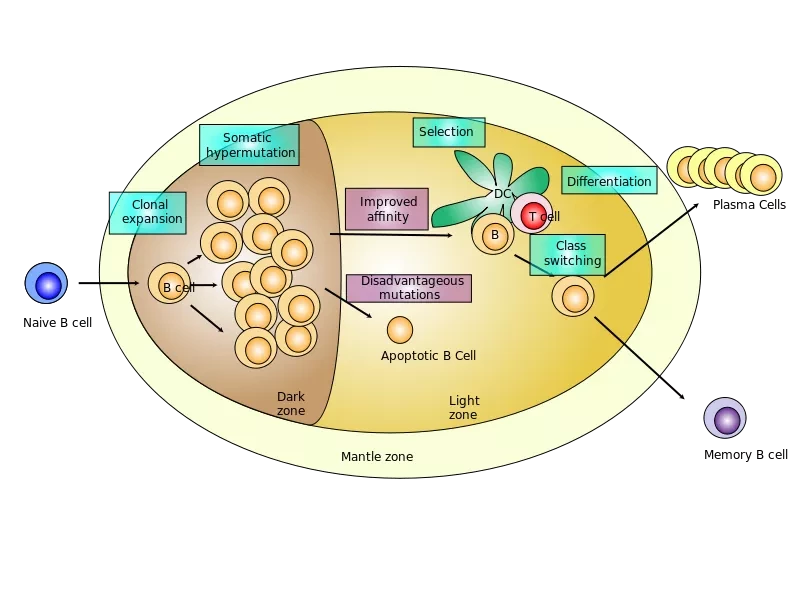
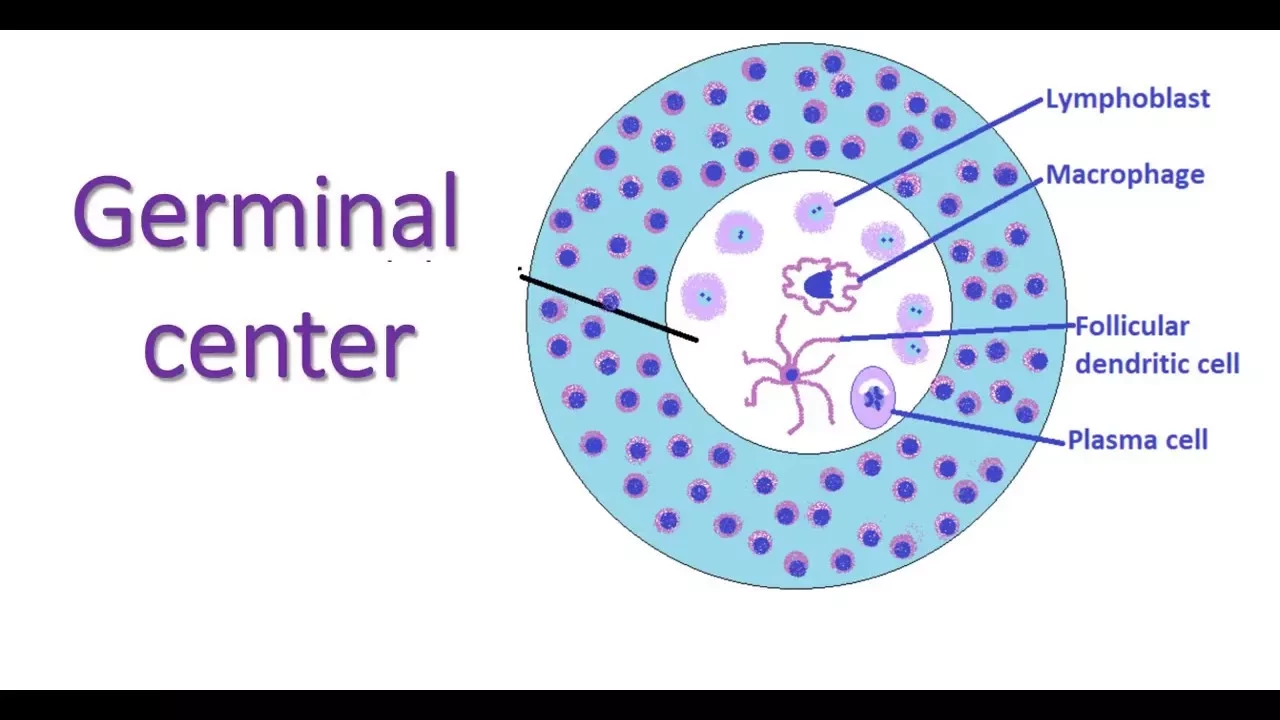
Иммунная система состоит из многих типов клеток, но два типа, которые имеют отношение к данному исследовательскому проекту - это CD4+ фолликулярные хелперные Т-клетки, и В-клетки. После того, как организм распознает инфекцию, фолликулярные хелперные Т-клетки выделяют химические сигналы, которые заставляют незрелые В-клетки учиться и запоминать, какие патогены следует атаковать. Этот процесс передачи сигналов от Т-клетки к В-клетке и обучения В-клетки происходит во временной клеточной структуре, называемой герминальным центром, в органах иммунной системы, включая селезенку, лимфатические узлы и миндалины. В-клетки памяти, развитые в таком зародышевом центре, запоминают патоген при первом инфицировании, а затем, если он снова попадает в организм, зрелые, обученные В-клетки памяти атакуют его, вызывая выработку антител, прежде чем патоген сможет размножиться.
"Целью вакцинации является производство высококачественных В-клеток памяти для длительной выработки антител", - говорит Мишель С. Дж. Ли, первый автор недавней публикации.
"При разработке вакцин для длительного иммунитета необходимо учитывать множество факторов, поэтому мы не должны концентрироваться только на герминальных центрах. Но если у вас нет функционального герминального центра, то вы будете очень восприимчивы к повторному инфицированию", - отметил Ли.
Однако количество укусов комаров и повторных заражений малярийным паразитом не ограничено. Каким-то образом малярийные паразиты ускользают от В-клеток памяти. Хотя дети чаще умирают от малярии, чем взрослые, некоторые люди могут серьезно заболеть, несмотря на любое количество предыдущих заражений малярией. "Пандемия COVID-19 привлекла внимание мировой общественности к инфекционным заболеваниям и интерес к разработке вакцин, поэтому у нас есть шанс возобновить внимание к таким забытым болезням, как малярия", - говорит Ли.
За многие годы научное сообщество выявило широкий спектр функций молекулы TBK1, фермента, который может изменять активность генов или других белков путем добавления химических меток, через процесс, называемый фосфорилированием. TBK1 играет хорошо известную роль в противовирусном иммунитете. Однако ни одна исследовательская группа не связывала TBK1 с судьбой В-клеток и герминальными центрами.
Исследователи генетически модифицировали мышей, у которых нефункциональные гены TBK1 были обнаружены только в определенных типах клеток, в основном либо в B-клетках, либо в CD4+ T-клетках. Такой нокаут TBK1 по типу клеток дает исследователям более четкое представление о том, что делает ген с множеством функций в различных клетках организма. Ли и коллеги заразили этих модифицированных мышей и здоровых взрослых мышей малярийным паразитом, наблюдали за ними, а затем исследовали образцы их селезенки и лимфатических узлов.
Микроскопия показала, что герминальные центры формируются только у тех мышей, у которых в В-клетках функционирует TBK1. Мыши, у которых в В-клетках отсутствовал TBK1, чаще и быстрее погибали от малярийной инфекции, чем их нормальные сородичи. Дополнительные эксперименты показали, что те немногие мыши, которые пережили малярию без TBK1 в В-клетках, способны использовать другие виды иммунного ответа, но они могут заразиться повторно. Однако удаление TBK1 только из фолликулярных хелперных Т-клеток CD4+ не оказало никакого влияния на герминальные центры или на то, как мыши переносили малярийную инфекцию.
Дальнейший анализ подтвердил, что без TBK1 многие белки в незрелых В-клетках имели аномальное фосфорилирование по сравнению с нормальными незрелыми В-клетками. Для различных генов аномальное фосфорилирование может вызвать либо аномальное увеличение, либо уменьшение активности. Исследователи подозревают, что в В-клетках активность TBK1 действует как выключатель для определенных генов, по сути, выключая гены, которые удерживают В-клетки в их незрелом состоянии.
"Это первое доказательство того, что TBK1 необходим В-клеткам для формирования герминальных центров и производства высококачественных зрелых антител",
- отметил Ли.
Исследователи надеются, что в конечном итоге, благодаря более фундаментальным знаниям об оставшихся загадках иммунной системы, будущие вакцины могут быть разработаны таким образом, чтобы вырабатывать более длительный иммунитет, возможно, без необходимости введения нескольких доз вакцины. Однако разработка вакцин всегда будет осложнена уникальными свойствами каждого патогена и его мутировавших версий, особенно в случае быстро развивающихся патогенов, таких как Sars-CoV-2.
"На данный момент мы можем, по крайней мере, сказать, что эффективная вакцина, созданная для выработки длительного защитного иммунитета, не должна снижать активность TBK1 в В-клетках", - заявил Ли.
Michelle S.J. Lee et al. TBK1, присущий В-клеткам, необходим для формирования герминального центра во время инфекции и вакцинации у мышей (аннотация).
Герминальный центр (ГЦ) - это место, где соматическая гипермутация и клональный отбор соединяются для созревания аффинных антител против инфекций. Однако то, как формируются и регулируются ГЦ, изучено не до конца. В данном исследовании мы выявили неожиданную роль Tank-связывающей киназы-1 (TBK1) как важнейшего В-клеточно-внутреннего фактора для формирования ГЦ. Используя модели иммунизации и малярийной инфекции, мы показали, что TBK1-дефицитные В-клетки не смогли сформировать ГЦ, несмотря на нормальную дифференцировку Tfh-клеток, хотя некоторые зараженные малярией В-клетки, специфичные для TBK1-дефицитных мышей, смогли выжить благодаря независимым от ГЦ механизмам.
Механистически, фосфорилирование TBK1 повышается в B-клетках во время дифференцировки ГЦ и регулирует баланс экспрессии IRF4/BCL6 путем ограничения активации CD40 и BCR через неканонические сигналы NF-κB и AKTT308. В отсутствие TBK1 сигналы CD40 и BCR синергически усиливали экспрессию IRF4 в Pre-GC, что приводило к подавлению BCL6, и поэтому не удавалось сформировать ГЦ.
В результате, В-клетки памяти, полученные из TBK1-дефицитных В-клеток, не могут обеспечить стерильный иммунитет при повторном заражении, что позволяет предположить, что TBK1 определяет судьбу В-клеток для развития длительного гуморального иммунитета.