Снижение уровня меди может уменьшить производство энергии, необходимой раковым клеткам для перемещения и закрепления в других частях тела в процессе метастазирования.
Таковы результаты нового исследования, проведенном учеными из Weill Cornell Medicine и Memorial Sloan Kettering Cancer Center (MSK). Открытие основных механизмов того, как истощение запасов меди может помочь уменьшить метастазирование при раке молочной железы, поможет разработать план будущих клинических испытаний.
В серии научных работ, опубликованных в период с 2013 по 2021 год, исследователи показали, что в клинических испытаниях II фазы, когда пациентки с тройным негативным раком молочной железы (TNBC) высокого риска лечились препаратом, снижающим уровень меди в организме, это продлевало период времени до рецидива рака и его метастазирования. В нынешнем исследовании, опубликованном в журнале Nature Communications, ученые использовали модели животных, чтобы более детально изучить причины этого явления.
"Одной из определяющих особенностей TNBC является то, что это очень агрессивная, трудно поддающаяся лечению форма заболевания, с высокой частотой метастатических рецидивов и небольшим количеством вариантов лечения", - говорит соавтор исследования Вивек Миттал, директор исследовательского центра рака легких Neuberger Berman и профессор кардиоторакальной хирургии в Weill Cornell Medicine. "Даже после операции и других видов лечения высок процент рецидивов, которые, как правило, возникают на ранних стадиях. Поэтому необходимы более эффективные методы лечения, направленные именно на этот тип рака".
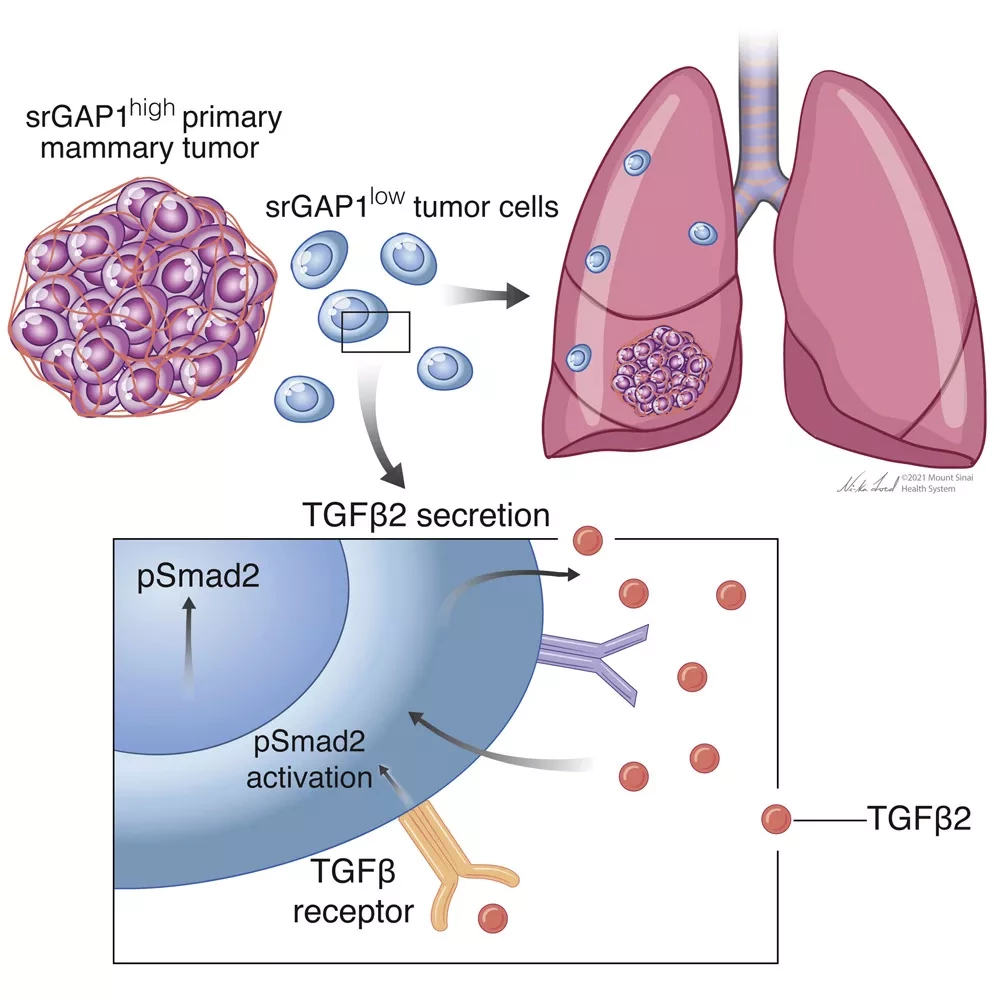
Многие биологические процессы, происходящие внутри клеток, требуют участия атомов металлов. Хотя железо, пожалуй, более известно, медь тоже играет важную роль. Медь необходима для процесса, называемого окислительным фосфорилированием (OXPHOS), который клетки используют для получения энергии митохондриями. Миттал показал, что метастатические раковые клетки TNBC имели высокий уровень внутриклеточной меди и повышенный уровень OXPHOS по сравнению с неметастатическими клетками. Исследователи предположили, что метастатическим клеткам может потребоваться много энергии, чтобы распространиться в другие части тела, поэтому блокирование доступности меди, отключающее их источник энергии, может стать хорошим способом предотвратить перемещение этих клеток.
Для снижения уровня меди исследователи как в предыдущем клиническом испытании, так и в последнем исследовании на животных использовали препарат тетратиомолибдат (ТМ), который разрабатывается для лечения болезни Вильсона. В мышиных моделях TNBC было обнаружено, что при снижении уровня меди в организме первичные опухоли продолжали расти, а способность рака к метастазированию значительно снижалась.
При ближайшем рассмотрении раковых клеток, обработанных ТМ, оказалось, что эти клетки изменили свой метаболизм таким образом, что им стало труднее вырабатывать энергию. Интересно, что этот неудачный энергетический статус привел в действие важнейший энергетический сенсор AMP-активированную протеинкиназу (AMPK). В отдельном исследовании ученые также обнаружили, что снижение уровня меди влияет на ремоделирование коллагена в так называемой предметастатической нише - участках тела, где раковым клеткам-изгоям легче закрепиться. Это помогло объяснить, как ТМ может затруднить колонизацию отдаленных органов путешествующими клетками TNBC.
"Эта работа основана на исследованиях, начавшихся в клинике, которые мы вернули в лабораторию", - рассказывает Миттал. "Теперь это переросло в очень интересную науку, которую мы можем перенести в более крупные клинические испытания. Мы можем использовать эту информацию для планирования нашего большого рандомизированного исследования рака молочной железы". В этом исследовании II фазы, включающем 177 пациентов, будет изучаться использование ТМ в качестве адъювантного лечения (назначаемого после завершения другого лечения) для снижения риска возвращения рака у пациентов с TNBC. Ожидается, что исследование начнет набор пациентов осенью 2022 года.
По словам Миттала, в ходе предыдущего исследования у пациентов было очень мало побочных эффектов от ТМ, который принимается два-три раза в день в виде таблеток.
"Мы истощаем медь в организме пациентов до такого уровня, когда нормальные функции клеток еще могут выполняться, но процессы, связанные с опухолью, уже невозможны",
- отметил он.
Лабораторные исследования будут важным компонентом предстоящего испытания, поскольку цель состоит в том, чтобы подобрать правильное лечение для правильного пациента в правильное время. Исследователи будут изучать ткани пациентов, чтобы проанализировать метаболические аспекты как опухолевых, так и здоровых тканей. Миттал планирует расширить полученные результаты, используя недавно полученный грант в размере 2,8 миллиона долларов от Национального института рака для изучения опосредованного медью метаболического перепрограммирования и изменений внеклеточного матрикса при метастазировании TNBC.
Ying L. Liu et al. Тетратиомолибдат (ТМ)-ассоциированное истощение меди влияет на ремоделирование коллагена и иммунный ответ в предметастатической нише рака молочной железы (аннотация).
Тетратиомолибдат (ТМ) - это новое соединение, разрушающее медь, которое ассоциируется с многообещающей выживаемостью в исследовании II фазы у пациентов с высоким риском и тройным негативным раком молочной железы. Мы попытались выяснить механизм действия ТМ, изучив его влияние на метаболизм коллагена и иммунную функцию в опухолевой микросреде (TME). Используя исследовательскую когорту, мы определили маркеры процессинга коллагена (LOXL2, PRO-C3, C6M и C1M), которые отличались между больными раком молочной железы и контрольной группой.
Мы измерили эти биомаркеры коллагена у пациентов, получавших лечение ТМ в рамках исследования II фазы, и обнаружили признаки снижения сшивки коллагена и увеличения деградации над образованием у пациентов без заболевания по сравнению с теми, у кого наблюдалось прогрессирование заболевания. Доклинические исследования выявили уменьшение отложения коллагена, снижение уровня миелоидных супрессорных клеток и увеличение инфильтрации CD4+ Т-клетками у мышей, получавших ТМ, по сравнению с контролем. Данное исследование раскрывает новые механизмы воздействия ТМ на ТМЕ и иммунный ответ с потенциальным применением при различных видах рака.