Иммунотерапия высвобождает силу иммунной системы для борьбы с раком.
Однако некоторым пациентам иммунотерапия не помогает, и новое исследование может помочь объяснить причину этого. Когда Т-лимфоциты проникают в злокачественные опухоли, генетическая программа этих Т-клеток и путь их развития могут повлиять на их ответ на иммунотерапию и предсказать общую выживаемость пациентов, говорится в новом исследовании, проведенном учеными Weill Cornell Medicine. Результаты этого исследования меняют сложившуюся модель иммунных реакций при меланоме и предлагают различные терапевтические подходы.
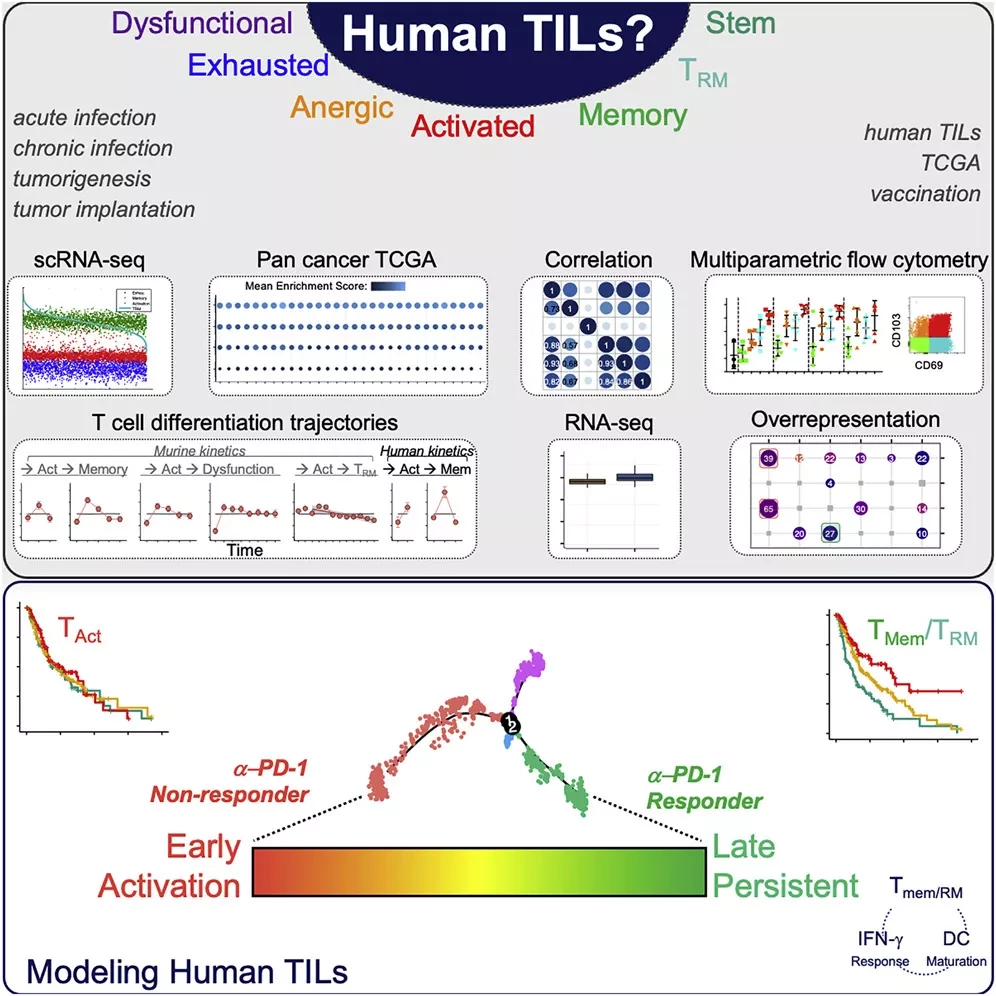
В исследовании, опубликованном в журнале Cancer Cell, исследователи проанализировали тысячи образцов опухолей человека, а также отдельные Т-клетки человека по многим совокупностям данных и типам опухолей и сравнили их с многочисленными моделями поведения Т-клеток в ответ на инфекции, рак и вакцины, включая человеческие вакцины. Они обнаружили, что Т-клетки либо застревают в состоянии ранней активации, либо превращаются в клетки памяти, которые расширяют текущие подходы к иммунотерапии.
"Т-клетки ведут себя не однозначно, но мы можем понять их поведение и смоделировать его таким образом, чтобы предсказать результаты и общую выживаемость пациентов", - говорит старший автор исследования Нирошана Анандасабапати.
Ученым давно известно, что иммунная система может самостоятельно обнаруживать и уничтожать опухолевые клетки, но иногда этот процесс нарушается, что приводит к развитию рака. Предыдущие данные, казалось, подтверждали теорию, согласно которой после образования опухоли Т-лимфоциты, попадающие в опухоль, продолжают видеть опухолевые белки и реагировать на них, пока не истощаются и не становятся неспособными атаковать раковые клетки. Эта теория использовалась для объяснения успеха терапии, называемой блокадой иммунных контрольных точек, которая использует клеточные сигналы для улучшения реакции Т-клеток, пробуждая их способность атаковать и уничтожать опухоль.
Однако опухоли некоторых пациентов не реагируют на блокаду контрольных точек иммунитета. Чтобы выяснить, почему, группа начала изучать большие массивы данных и анализировать их более широко, чем в предыдущих исследованиях. "Мы хотели использовать абсолютно агностический подход к попытке понять, что происходит с Т-клетками, когда они попадают в микросреду опухоли - действительно беспристрастный, непредвзятый подход", - рассказывает Анандасабапати.
Используя масштабные программы многих генетических маркеров и многочисленные, одновременные геномные стратегии для классификации судьбы клеток, Анандасабапати и ее коллеги смогли заново классифицировать Т-клетки в опухолях и лучше смоделировать их развитие. Результаты показывают, что инфильтрирующие Т-клетки не все одинаково развиваются в каждой опухоли. В отличие от стандартной точки зрения, проблемой является "неспособность к запуску" после ранней активации и преобразования в память, а не истощение. Обогащение долгоживущих программ памяти сильно коррелирует с общей выживаемостью и успешным ответом на терапию блокадами иммунных чекпойнтов при меланоме.
Помимо прогнозирования исходов, исследователи надеются найти способы их изменения. Например, если заставить Т-клетки не запускаться и вызвать образование опухоль-инфильтрирующих Т-клеток памяти у пациентов, у которых они отсутствуют, это может сделать не реагирующие опухоли чувствительными к блокаде иммунных контрольных точек.
Хотя нынешняя работа была посвящена злокачественной меланоме, ученые также установили, что аналогичные явления, вероятно, лежат в основе различий в реакции Т-клеток пациентов на другие виды рака, включая рак почек, мочевого пузыря, простаты и печени. "Эффект нашего исследования заключается в том, что оно открывает новые пути и предлагает более рациональные методы лечения", - заявила Анандасабапати.
Abhinav Jaiswal et al. Траектория активации и дифференцировки памяти опухоль-инфильтрирующих лимфоцитов определяет исход метастатической меланомы (аннотация).
Существует необходимость в лучшей классификации и понимании опухоль-инфильтрирующих лимфоцитов (TILs). В данном исследовании мы применили передовую функциональную геномику для изучения 9000 опухолей человека и множества наборов секвенирования единичных клеток с использованием эталонных состояний Т-клеток, комплексных траекторий дифференцировки Т-клеток, вакцинных ответов человека и мышей, а также других TILs человека.
По сравнению с другими состояниями Т-клеток, в солидных опухолях наблюдалось обогащение программ Т-памяти/резидентной памяти. Анализ траектории движения единичных CD8+ TILs меланомы также выявил высокую долю TILs с памятью/резидентной памятью в отвечающих на анти-PD-1, которая расширилась после терапии. Напротив, TILs с высоким баллом ранней активации Т-клеток, но не истощения, ассоциировались с отсутствием ответа. Признаки поздней/постоянной, но не ранней активации, прогнозируют выживаемость меланомы и коэкспрессируются с программами ответа дендритных клеток и IFN-γ.
Эти данные выявляют состояние, подобное активации, связанное с плохим ответом, и предполагают, что успешная конверсия памяти, а не реанимация истощения, является недооцененным аспектом успешного противоопухолевого иммунитета.