Прямо сейчас в вашем теле скрываются тысячи клеток с ошибками в ДНК, которые могут вызвать рак. Однако лишь в редких случаях эти генетические мутации, приводят к развитию полноценного рака. Почему?
Стандартное объяснение заключается в том, что необходимо определенное количество генетических "ударов" по ДНК клетки, чтобы она перешла грань дозволенного. Но хорошо известны случаи, когда один и тот же набор мутаций вызывает рак в одном контексте, но не в другом. Хороший пример - родинка. Клетки, составляющие родинку, генетически аномальны. Довольно часто они содержат мутировавший вариант ДНК гена BRAF, который, будучи обнаруженным в клетках, расположенных вне родинки, часто приводит к меланоме. Но подавляющее большинство родинок никогда не становятся раковыми. Эта загадка заставила ученых обратиться к клеточному контексту в поисках подсказок для объяснения разницы.
Исследователи попытались изучить, как генетика рака и биология развития взаимодействуют при развитии рака. Спустя десятилетие совместных усилий были получены результаты. В статье, опубликованной в Science, Ричард Уайт и Лоренц Штудер сообщают, что образование меланомы зависит от так называемой "онкогенной компетентности", которая является результатом взаимодействия между мутациями ДНК в клетке и определенным набором генов, активированных в этой клетке. Клетки, компетентные к образованию меланомы, способны получить доступ к набору генов, которые обычно закрыты для зрелых меланоцитов (клеток, вырабатывающих меланин и придающих коже цвет). Для того чтобы получить доступ к этим закрытым генам, клеткам требуются особые белки, которые действуют как ключи. Без них клетки не образуют меланому, даже если в них имеются раково-ассоциированные мутации ДНК.
Полученные результаты дают объяснение тому, почему некоторые клетки могут формировать рак, и предлагают потенциальные терапевтические мишени, которые в один прекрасный день могут помочь пациентам. Совместный проект стартовал более десяти лет назад и начался с наблюдения, которое Уайт сделал, будучи еще постдоком, изучая меланому у зебрафиш. Эти крошечные рыбки отлично подходят для изучения развития меланомы, поскольку можно видеть опухоли, растущие под чешуей рыбы, и легко изучать их на молекулярном уровне. "Когда мы изучали эти меланомы у зебрафиш, мы увидели, что там был ряд активных генов, которые более характерны для эмбриональных клеток, а не для зрелых меланоцитов", - говорит Уайт. "Нам было интересно, почему эти гены активированы. Важны ли они для развития меланомы, и если да, то каким образом?".
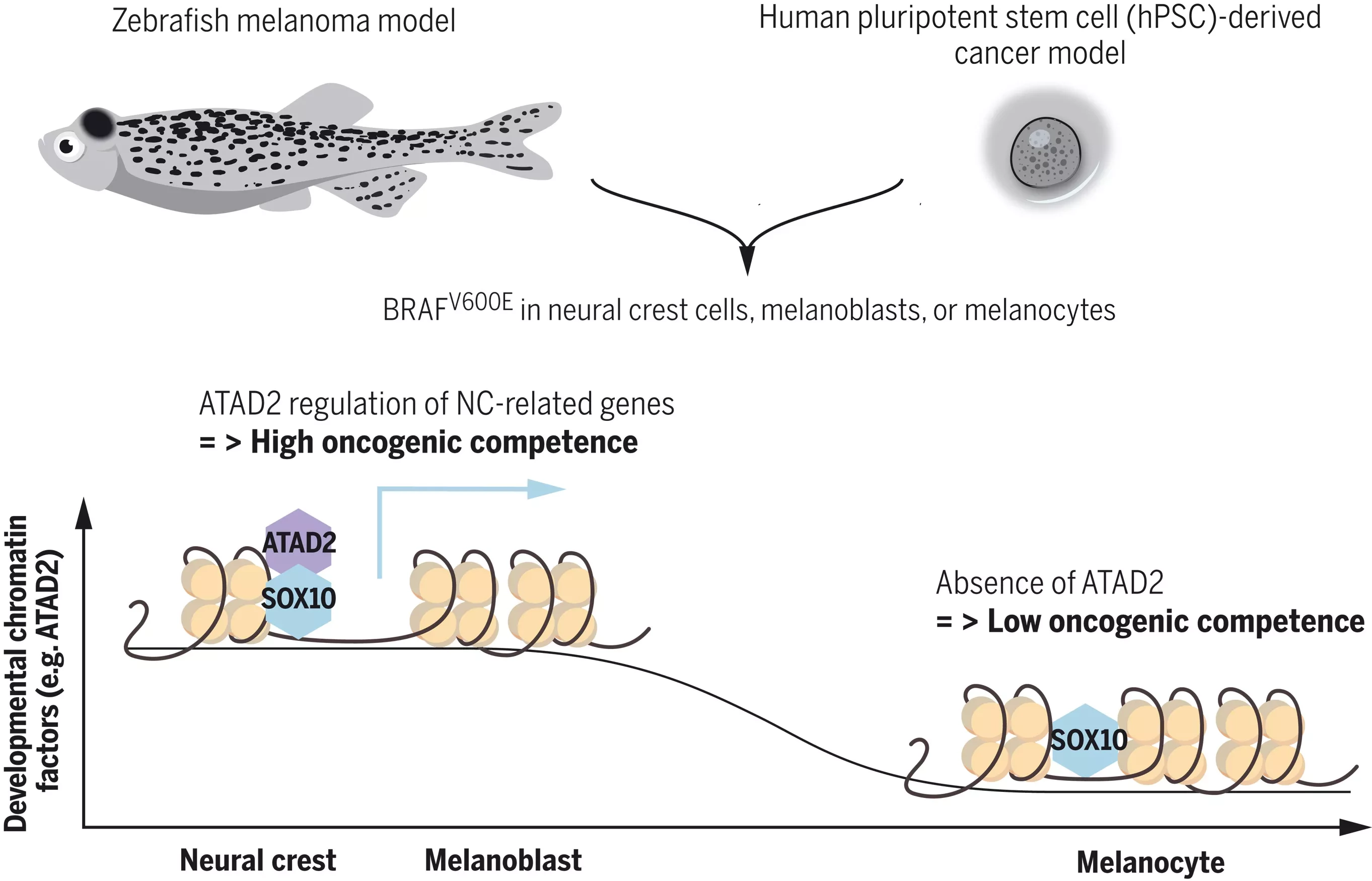
Чтобы ответить на этот вопрос, Уайт и его коллеги генетически модифицировали зебрафиш, чтобы они содержали мутировавший ген BRAF - тот самый, который встречается примерно в половине меланом. Они ввели ген BRAF таким образом, чтобы он активировался на трех различных стадиях развития меланоцитов у разных рыб: на стадии нервного гребня (NC), стадии меланобластов (MB) и стадии меланоцитов (MC). Эти стадии относятся к состояниям клеток, которые постепенно становятся более дифференцированными. (Можно представить эти стадии как детский сад, начальную школу и среднюю школу). Затем они позволили рыбам вырасти и наблюдали за появлением опухолей.
Через несколько месяцев они обнаружили, что только рыбы с BRAF, активированным на стадиях NC и MB, были способны образовывать опухоли (то, что исследователи называют "онкогенной компетентностью"). Клетки с BRAF, активированным на стадии MC, вместо этого образовывали родинки.
Результат был поразительным. Но то, что верно для рыб, не обязательно верно для людей. Поэтому, чтобы расширить полученные результаты, Уайт объединился с Штудером для проведения аналогичных экспериментов на человеческих клетках. Команда Штудера ранее показала, что они могут использовать человеческие плюрипотентные стволовые клетки (hPSC) для создания каждой из трех стадий развития меланоцитов. В данном случае они ввели мутировавший ген BRAF в hPSC на тех же трех стадиях, которые были изучены у рыб, а затем имплантировали эти клетки мышам, чтобы посмотреть, какие из них способны образовывать опухоли. И снова, только первые две стадии - NC и MB - были последовательно способны образовывать опухоли.
Воодушевленные этими результатами, исследователи пошли дальше, чтобы изучить возможный механизм этого явления. Используя молекулярное профилирование, они сравнили, чем отличаются активные гены на трех стадиях - как для опухолей зебрафиш, так и для опухолей, полученных из стволовых клеток человека. Из этого сравнения они смогли увидеть, что ключевым отличием был определенный белок, ATAD2, который был активен в клетках NC и MB, но не в клетках MC. ATAD2 - это так называемый фактор модификации хроматина: он связывается с участками хромосомы вблизи генов и позволяет этим генам включаться (технически, транскрибироваться в мессенджерную РНК) и переводиться в белок. Белки, подобные ATAD2, изменяют "эпигеном" клетки - то, как ДНК упакована в клетке, а не "геном" - последовательности самой ДНК. Клетки с ATAD2 могут активировать уникальный набор генов, которые обычно проявляются только в эмбриональном развитии, а клетки без него - нет. Другими словами, ATAD2 - это ключ, который отпирает эти гены.
Чтобы доказать, что ATAD2 играет решающую роль, ученые провели дополнительные эксперименты, в которых они либо убирали ATAD2, либо добавляли его обратно. Когда ученые удалили ATAD2 в модели зебрафиш, подверженной меланоме, клетки потеряли способность образовывать опухоли. Когда они добавили его в клетки MC, клетки приобрели эту способность. Это подсказало исследователям, что ATAD2 действительно является главным рычагом онкогенной компетентности. Воспользовавшись огромным количеством клинических данных, имеющихся в Атласе генома рака, они смогли показать, что ATAD2 играет важную роль в развитии рака: пациенты с высоким содержанием ATAD2 имеют значительно худшую выживаемость, что позволяет предположить, что он играет важную роль в определении исхода мутаций ДНК, таких как BRAF.
Ученые говорят, что их результаты предлагают новый важный взгляд на формирование рака, который противоречит общепринятому мнению. "Стандартная идея, существовавшая на протяжении десятилетий, заключается в том, что для возникновения рака необходимы два типа мутаций ДНК: активированный онкоген и отключенный ген опухолевого супрессора", - говорит Уайт. "Как только вы преодолеете эти два препятствия, образуется рак. Теперь у нас есть совершенно другая вещь - онкогенная компетентность, которая добавляет третий компонент". Арианна Баджолини, ведущий автор исследования, сравнивает ситуацию с разжиганием костра.
"Мутации ДНК - это как зажженная спичка: если у вас не те дрова или дрова влажные, вы можете получить небольшое мерцание, но не огонь. Но если у вас есть правильные дрова и, возможно, немного хвороста, все загорится".
В данном примере ATAD2 - это хворост. Разработка препарата для удаления этого хвороста стала бы еще одним способом лечения рака, помимо воздействия на мутации ДНК. Методы исследования hPSC, разработанные командой для изучения меланомы, могут найти широкое применение в персонализированном лечении рака. Уже сейчас Уайт и Штудер используют этот метод для создания моделей рака отдельных пациентов. Из крови пациента они могут получить клетки для создания hPSC. Затем они могут ввести в эти клетки специфические мутации, характерные для опухоли пациента. Затем эти генетически подобранные клетки могут быть использованы для тестирования большой группы лекарственных препаратов, чтобы определить, какие из них могут помочь пациенту. Затем эти препараты могут быть перенесены на зебрафиш, чтобы убедиться, что они действительно работают на живых организмах. Исследователи считают, что такой переход от клеточных культур к исследованиям на животных дает им наилучшие шансы найти препараты, которые будут работать на пациентах.
"С помощью hPSCs мы потенциально можем создавать специфические для пациента модели раковых заболеваний для любой ткани организма, будь то мозг, печень или другой орган", - говорит Штудер. "Я очень надеюсь, что это станет обычной частью лечения". Вероятно, не случайно, что эти далеко идущие результаты являются результатом стабильного, десятилетнего сотрудничества двух лабораторий с разным опытом. "Это стало почти клише - говорить, что наука лучше в сотрудничестве, но в данном случае это действительно имело решающее значение", - говорит Уайт.
Он добавляет: "Все хотят, чтобы наука развивалась быстро. Мы тоже хотим, чтобы наука шла быстро. Но иногда наука должна идти медленно, чтобы добраться до главной истины".
Arianna Baggiolini et al. Программы развития хроматина определяют онкогенную компетентность в меланоме (аннотация).
Онкогены трансформируют клетки только в определенных клеточных условиях - явление, называемое онкогенной компетентностью. Используя сочетание модели рака, полученной из плюрипотентных стволовых клеток человека, и трансгенеза зебрафиш, мы продемонстрировали, что способность BRAFV600E к трансформации наряду с дополнительными мутациями зависит от внутренней транскрипционной программы, присутствующей в исходной клетке. В обеих системах меланоциты менее восприимчивы к мутациям, в то время как популяции нервного гребня (neural crest) и меланобластов легко трансформируются.
Профилирование показывает, что в прогениторах наблюдается более высокая экспрессия хроматин-модифицирующих ферментов, таких как ATAD2, фактора компетентности меланомы, который образует комплекс с SOX10 и позволяет экспрессировать нижележащие онкогены и программы нервного гребня. Эти данные позволяют предположить, что онкогенная компетентность опосредована регуляцией факторов развития хроматина, которые затем позволяют правильно реагировать на эти онкогены.