Новое исследование может помочь объяснить, почему долгое время находящиеся в состоянии покоя раковые клетки могут внезапно стать более агрессивными.
Раковые клетки могут попасть в кровоток и вторгнуться в костную и другие ткани вскоре после образования первичной опухоли. В костях эти диссеминированные опухолевые клетки (DTC) прячутся в периваскулярной нише - пространстве, окружающем кровеносные сосуды, где они могут оставаться в спящем состоянии в течение длительного времени, прежде чем необъяснимо пробудиться, готовые колонизировать окружающие ткани. Колонизация - последний этап метастазирования в костной ткани - часто происходит спустя годы после удаления первичных опухолей, и от ее последствий, по оценкам, ежегодно умирают сотни тысяч пациентов. "Если рак уже находится в костной ткани, что заставляет его вновь развиваться?" - задается вопросом Сян Х.-Ф. Чжан, исследователь рака из Медицинского колледжа Бэйлора.
Случаи метастазирования костной ткани после операций по установке зубных имплантатов, а также эпидемиологические исследования, свидетельствующие о повышении риска метастазирования костной ткани после переломов костей, привели исследователей к предположению, что процесс ремоделирования кости после травмы может дать толчок делению раковых клеток. В исследовании, опубликованном 26 октября в журнале Cancer Discovery, Чжан и его коллеги обнаружили, что после перелома кости DTC у мышей присоединяются к периваскулярным стволовым клеткам, которые организм направляет к местам травм, чтобы начать процесс заживления. Как только они достигают места перелома, раковые клетки начинают размножаться параллельно с процессом ремоделирования кости, в ходе которого поврежденная кость рассасывается, а на ее месте образуется новая.
"Это очень важное исследование, потому что оно подтверждает клинические данные, которые показывают, что повышенная резорбция кости способствует росту опухоли в костной ткани, и объясняет механизм, с помощью которого это может происходить", - говорит Тереза А. Гиз, исследователь рака, изучающий механизмы костного метастазирования в онкологическом центре Техасского университета и не участвовавшая в данной работе. "Эти результаты продвигают наше понимание костных метастазов и указывают на возможную причину того, почему пациенты с костными метастазами плохо себя чувствуют, когда у них случается перелом".
Предыдущие исследования Чжана показали, что костные метастазы обычно возникают в остеогенных нишах - областях, где обитают клетки, строящие кости, такие как остеобласты и их клеточные предшественники. Этот вывод заставил его и его коллег углубиться в изучение вопроса о том, почему ремоделирование костей может усиливать распространение раковых клеток. Чтобы подтвердить этот эффект, они сосредоточились на времени, когда ремоделирование костей наиболее активно: после перелома. Команда имплантировала мышам опухоли, полученные из мышиных тканей, с биолюминесцентными генами. Примерно через 17 дней исследователи удалили опухоли и произвели перелом бедренной кости у некоторых животных. После того как в течение еще 17 дней происходило ремоделирование кости, биолюминесцентная визуализация показала, что раковые клетки широко распространились в сломанных бедренных костях и почти не распространились в неповрежденной кости.
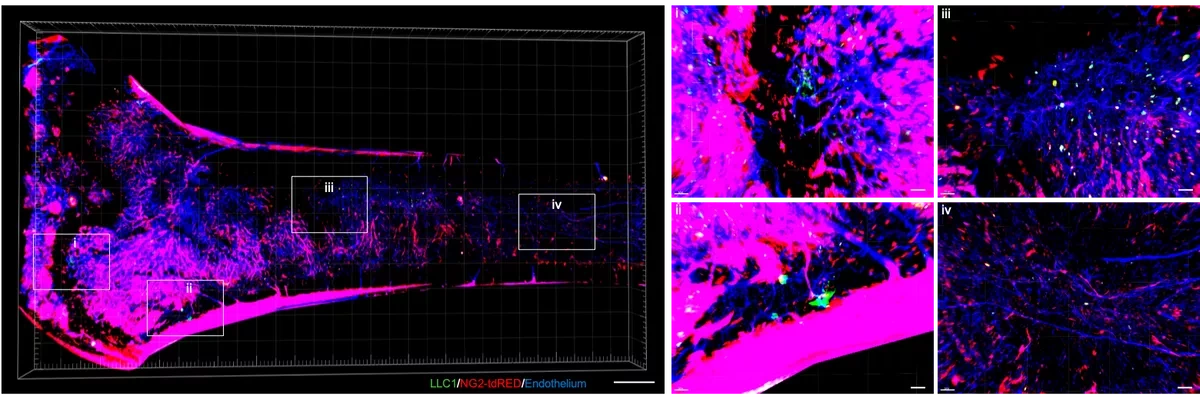
Затем исследователи изучили механизмы, которые могли бы объяснить этот результат, повторив эксперимент по биолюминесцентной визуализации на мышах, у которых были истощены определенные типы костных клеток. Травмированные бедренные кости мышей с пониженным уровнем NG2+ клеток - типа стволовых клеток, которые могут дифференцироваться в костеобразующие остеобласты - показали меньшее количество костных метастазов, чем кости мышей с нормальным уровнем этих клеток, что позволяет предположить, что эти клетки играют роль в доставке раковых клеток к местам переломов. NG2+ клетки, которые, как и DTCs, обитают в периваскулярном пространстве, мигрируют в остеогенную нишу, где, по словам Чжана, его эксперименты показывают, что "нормальная функция этих клеток - способствовать ремоделированию костной ткани". Пространственный анализ тканей с костными метастазами показал наличие NG2+ клеток и DTCs в соседних и часто перекрывающихся местах, что является дополнительным доказательством того, что связь между этими двумя типами клеток может объяснить взаимодействие между ремоделированием костей и ростом опухоли.
Запечатлеть миграцию двух типов клеток в реальном времени на животных практически невозможно с помощью современных технологий, говорит Чжан, но эксперименты in vitro показали, что NG2+ и раковые клетки обладают способностью прилипать друг к другу и перемещаться в тандеме. "Таким образом, эти два типа клеток определенно могут работать вместе", - говорит он, добавляя, что клеем между ними служат две формы молекулы адгезии под названием кадхерин. Форма молекулы адгезии, вырабатываемая стволовыми клетками, называется N-кадхерин, а тип, вырабатываемый раковыми клетками, называется E-кадхерин.
Чтобы выяснить, применимы ли процессы, которые они наблюдали у мышей, к людям, Чжан с коллегами проанализировали экспрессию белков in situ в хирургически удаленных образцах ранних стадий костных метастазов человека, вызванных различными типами рака, включая рак груди, простаты, толстой кишки и легких. Исследователи обнаружили NG2+ и N-кадхерин в клетках, прилегающих к раковым клеткам, предполагая, что ремоделирование костей может влиять на метастазирование независимо от исходного типа раковых клеток, хотя Чжан отмечает, что исследователи еще не изучили это подробно.
"Использованные авторами методы являются самыми современными, а данные - всеобъемлющими", - говорит Гиз, добавляя, что "вишенка на торте заключается в том, что авторы подтвердили свои экспериментальные результаты на костных метастазах человека, что еще больше подкрепляет это исследование".
В дальнейших экспериментах у мышей с истощенными NG2+ стволовыми клетками наблюдалась меньшая колонизация костной ткани DTCs даже при отсутствии переломов, что говорит о том, что даже гомеостатическое ремоделирование костной ткани, которое происходит постоянно, может усугубить костное метастазирование. По словам Чжана, это означает, что люди, у которых скорость ремоделирования костей выше, например, страдающие остеопорозом, могут быть подвержены более высокому риску метастазирования. Гиз согласна с такой оценкой, но она отмечает, что остеопороз у пожилых людей не всегда связан с более быстрой резорбцией костной ткани.
Возможно, можно предотвратить костное метастазирование, атакуя связь между молекулами N-кадхерина и E-кадхерина, экспрессируемыми раковыми клетками, предполагает Чжан. Однако исследователи обнаружили, что устранение N-кадхерина замедляет скорость ремоделирования костной ткани у мышей. По его словам, препятствовать заживлению костей для предотвращения костных метастазов - не самый лучший подход, поэтому в будущих исследованиях он и его коллеги сосредоточатся на атаке на E-кадхерин.
Хотя Гиз считает, что предложенный Чжаном терапевтический подход многообещающий, она отмечает, что "терапия должна быть направлена только на костную ткань, так как потеря Е-кадхерина может способствовать развитию злокачественных опухолей в других местах". Она объясняет, что мутации в генах, которые обычно кодируют E-кадхерин, связаны с раком молочной железы и желудка у людей.
Прерывание связи между молекулами кадхерина может не только предотвратить метастазирование в кости, утверждает Чжан, поскольку по мере роста опухоли DTC могут перемещаться из костной ткани в другие органы, где они снова могут метастазировать.
"Мы считаем, что если нам удастся разорвать эту связь, то мы не только снизим риск метастазирования в костях, но и дальнейшего метастазирования в другие органы".
Weijie Zhang et al. Инициация костного метастазирования связана с ремоделированием костной ткани через остеогенную дифференцировку NG2+ клеток (аннотация).
Микросреда костной ткани динамична и подвергается ремоделированию в нормальных и патологических условиях. Влияет ли такое ремоделирование на распространение опухолевых клеток и метастазирование в кости, остается малоизученным.
В данном исследовании мы продемонстрировали, что патологические переломы усиливают метастатическую колонизацию вокруг повреждения. NG2+ клетки являются общим участником инициации костных метастазов и ремоделирования костей как в гомеостатических условиях, так и при переломах. NG2+ костные мезенхимальные стромальные клетки (BMSCs) часто совместно локализуются с DTCs в периваскулярной нише. Как DTCs, так и NG2+ BMSCs рекрутируются в места ремоделирования. Абляция линии NG2+ нарушает ремоделирование кости и одновременно уменьшает метастатическую колонизацию. В ко-культурах NG2+ BMSCs, особенно при остео-дифференцировке, усиливали пролиферацию и миграцию раковых клеток. Нокаут N-кадхерина в NG2+ клетках отменял эти эффекты in vitro и фенокопировал истощение NG2+ линии in vivo.
Эти данные раскрывают двойную роль NG2+ клеток в метастазировании и ремоделировании и указывают на то, что остеодифференцировка BMSCs способствует инициации метастазирования через N-кадхерин-опосредованное взаимодействие клеток с клетками.