Молекулярные мишени для терапии, которая может предотвратить рецидив рака молочной железы, были определены группой немецких, норвежских и британских ученых, которые проанализировали опухолевые клетки, оказавшиеся устойчивыми к первоначальному лечению.
Последние достижения в области раннего выявления и целенаправленной терапии привели к растущему успеху в лечении рака молочной железы при его первичной диагностике. Часто это достигается путем подавления онкогенов, вызывающих развитие опухоли, и регрессии опухоли. Однако выживание небольшого количества опухолевых клеток после первоначальной терапии представляет собой все большую проблему, поскольку такие клетки приводят к последующему рецидиву неизлечимого рака у 20%-40% пациентов через несколько лет или даже десятилетий. Результаты исследования, опубликованные в журнале Molecular Systems Biology, потенциально важны для результатов лечения рака молочной железы, поскольку они могут помочь в борьбе с рецидивами опухоли.
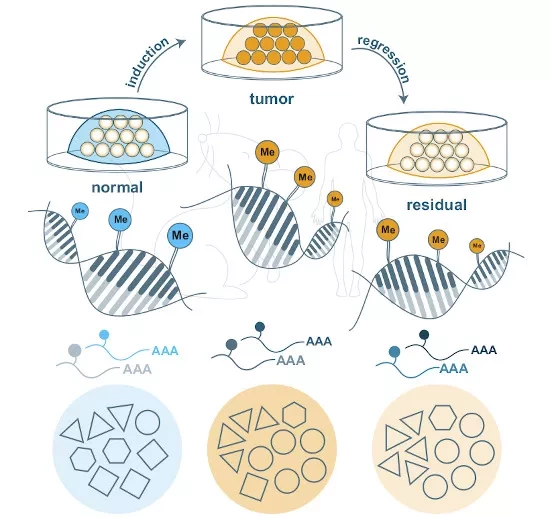
Онкогены - это гены, повышенная экспрессия которых связана со многими видами рака в результате либо мутаций, либо изменений в контроле над их экспрессией. Одним из основных процессов, вовлеченных в повышенную экспрессию онкогенов в процессе опухолевого генеза, является метилирование ДНК - присоединение метильных групп к молекулам ДНК, что приводит к изменению экспрессии соответствующих генов. Группа ученых проанализировала изменения метилирования в небольшом количестве клеток, которые пережили первоначальное лечение, что обозначается термином "минимальное остаточное заболевание" (MRD). MRD клетки могут пролиферировать после значительной фазы покоя и тем самым вызывать неизлечимый рецидив рака. Применяя передовые методы интенсивной обработки данных в мышиной модели рака молочной железы и интегрируя различные уровни клеточного поведения, метаболизм и метилирование клеток MRD сравнивались с теми же процессами в исходных опухолевых клетках и нормальных здоровых клетках.
Главным результатом стало то, что устойчивые клетки демонстрировали очень схожее метаболическое поведение и характер метилирования с клетками исходной опухоли, но не с нормальными клетками. Однако они не демонстрировали других характеристик исходных опухолевых клеток, таких как высокая склонность к пролиферации и наличие онкогенной сигнализации. Таким образом, исследователи пришли к выводу, что клетки MRD несут в себе некую форму "метаболической и эпигенетической памяти" о состоянии опухоли. Этот вывод был подтвержден с помощью транскриптомных данных, полученных от пациентов после проведения неоадъювантной терапии, которая обычно представляет собой химиотерапию для уменьшения размеров опухоли перед последующим хирургическим иссечением.
Далее исследователи продемонстрировали, что "сохраненный в памяти" гликолиз в клетках MRD имеет решающее значение для их выживания, генерируя энергию, необходимую для поддержания клеточного метаболизма, в виде аденозинтрифосфата (АТФ) из глюкозы. Этот процесс запоминания является очевидной терапевтической мишенью, и исследователи уже определили маленькую молекулу, которая ингибирует этот путь в MRD, не оказывая никакого влияния на нормальные здоровые клетки.
Хотя сама по себе эта молекула, возможно, не приведет непосредственно к будущим методам лечения, важным аспектом данной работы является то, что она позволила получить углубленный молекулярный взгляд на MRD путем всестороннего сравнения нормального, опухолевого и резистентного к лечению состояния клеток. Использование трехмерных клеточных культур - также известных как органоиды - позволило исследователям изучить редкие остаточные клетки, которые трудно получить в клинических условиях. Таким образом, исследование не только позволяет найти конкретную цель для борьбы с рецидивами рака молочной железы, но и использовать органоидный подход, который в будущем может быть распространен на клетки, полученные от пациентов, для целей прецизионной медицины.
Ksenija Radic Shechter et al. Метаболическая память, лежащая в основе минимальной остаточной болезни при раке молочной железы (аннотация).
Рецидив опухоли из резистентных к лечению клеток (минимальная остаточная болезнь, MRD) лежит в основе большинства смертей от рака молочной железы. Тем не менее, молекулярные характеристики, определяющие их злокачественность, в основном остаются неустановленными. В данной работе мы объединили данные мультиомики, полученные с помощью прослеживаемой органоидной системы, с подходом метаболического моделирования, чтобы раскрыть метаболические и регуляторные особенности MRD. Мы обнаружили, что устойчивые клетки, несмотря на их непролиферативный фенотип и отсутствие онкогенной сигнализации, характеризуются повышенным гликолизом и активностью некоторых ферментов цикла мочевины, характерных для опухоли.
Эта метаболическая отличительная особенность была также очевидна в мышиной модели и в транскриптомных данных пациентов после неоадъювантной терапии. Кроме того, мы выявили заметное сходство в профилях метилирования ДНК между опухолевыми и остаточными клетками. В совокупности наши данные свидетельствуют о метаболической и эпигенетической памяти резистентных к лечению клеток. Мы также продемонстрировали, что запомненный повышенный гликолиз в MRD имеет решающее значение для их выживания и может быть атакован с помощью низкомолекулярного ингибитора без воздействия на нормальные клетки. Таким образом, метаболические нарушения MRD открывают новые терапевтические возможности для последующего лечения с целью предотвращения рецидива опухоли молочной железы.