В новом исследовании ученые из Каролинского института выявили наличие специфической связи между белком и молекулой lncRNA при раке печени.
При увеличении присутствия молекулы lncRNA жировые запасы опухолевой клетки уменьшаются, что приводит к прекращению деления опухолевых клеток, и они в конечном итоге погибают. Исследование, опубликованное в журнале Gut, способствует расширению знаний, которые могут способствовать улучшению диагностики и будущему лечению рака.
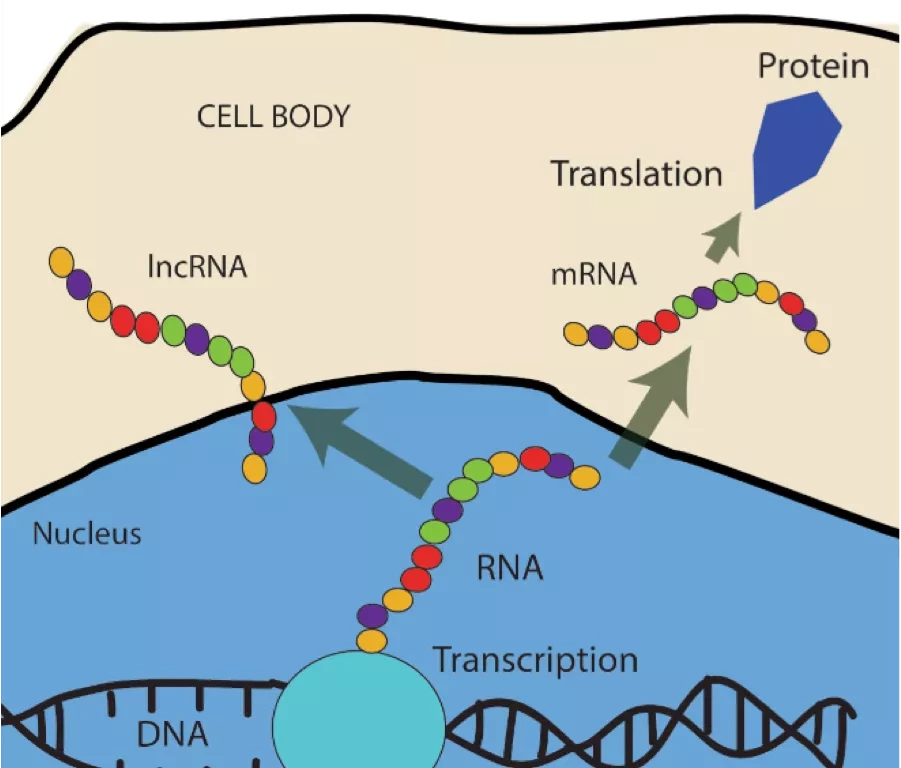
Наш геном дает клеткам инструкции, которые определяют узкоспециализированные функции каждого типа клеток. Информация передается с помощью двух различных типов молекул РНК: кодирующей РНК, которая преобразует ДНК в белки, и некодирующей РНК, которая не производит белки. Поскольку молекулы некодирующей РНК не производят белки, в прошлом они не были в центре внимания исследователей, хотя на них приходится около 97% РНК в нашем организме. Однако было доказано, что некоторые белки, называемые РНК-связывающими белками, играют решающую роль в развитии рака благодаря своей способности влиять на несколько различных свойств молекул РНК.
"С помощью тканевого материала, пожертвованного пациентами с раком печени, мы смогли составить карту кодирующей и некодирующей части генома, чтобы определить, какие РНК-связывающие белки в большом количестве присутствуют в клетках рака печени", - говорит старший автор исследования Клаудия Куттер, научный сотрудник отделения микробиологии, биологии опухолей и клеток Каролинского института. "Мы обнаружили, что многие из этих белков взаимодействуют с длинным типом некодирующих молекул РНК, так называемых lncRNA".
Исследовательская группа провела более детальное изучение конкретной пары РНК-связывающего белка (CCT3) и молекулы lncRNA (LINC00326). Используя передовую технологию CRISPR, они смогли как уменьшить, так и увеличить количество белка и lncRNA, чтобы увидеть, как это влияет на раковые клетки. Когда количество lncRNA увеличивалось, жировые запасы опухолевой клетки уменьшались, деление клеток прекращалось, и многие раковые клетки погибали. После лабораторных исследований результаты также были проверены in vivo.
Открытие исследователей дает представление о взаимодействии между РНК-связывающими белками и молекулами lncRNA и способствует лучшему научному пониманию их роли в опухолях.
"Деятельность пары CCT3-LINC00326 уже может быть использована в диагностике и прогнозировании рака печени",
- говорит Куттер. "Однако знание этой конкретной пары - это только начало, и существует еще много комбинаций РНК-связывающих белков и молекул lncRNA, которые мы будем изучать дальше. В долгосрочной перспективе эти результаты могут способствовать созданию новых эффективных методов лечения, таких как лечение на основе РНК, направленное только на больные клетки, с возможностью снижения побочных эффектов".
Jonas Nørskov Søndergaard et al. Ось CCT3-LINC00326 регулирует липидный обмен гепатоканцерогенов (аннотация).
Цель.
Для лучшего понимания транскрипционных фенотипов раковых клеток мы глобально охарактеризовали РНК-связывающие белки (RBPs) для выявления измененных РНК, включая длинные некодирующие РНК (lncRNAs).
Дизайн.
Чтобы раскрыть взаимодействие RBP-lncRNA при раке, мы составили список из ~2300 высоко экспрессированных RBP в клетках человека, проверили влияние RBP и lncRNA на выживаемость пациентов в различных когортах, изменили уровни экспрессии, интегрировали различные данные секвенирования, молекулярные и клеточные данные.
Результаты.
Высокая экспрессия RBPs негативно влияет на выживаемость пациентов при 21 типе рака, особенно при гепатоцеллюлярной карциноме (ГЦК). После нокдауна 10 самых высокорегуляторных RBPs и последующего анализа транскриптома мы выявили 88 дифференциально экспрессированных lncRNAs, включая 34 новых транскрипта. CRISPRa-опосредованная сверхэкспрессия четырех lncRNA оказала значительное влияние на фенотип и транскриптом клеток ГЦК. Дальнейшее исследование четырех пар RBP-lncRNA показало их вовлеченность в различные регуляторные процессы. Наиболее заметная связь RBP-lncRNA влияла на липидный обмен, при этом неканонический RBP CCT3 регулировал LINC00326 шаперонин-независимым образом. Нарушение регуляторной сети CCT3-LINC00326 привело к снижению накопления липидов и увеличению их деградации in cellulo, а также к снижению роста опухоли in vivo.
Выводы.
Мы обнаружили, что экспрессия генов RBP нарушена в ГЦК и определили, что RBP выполняют дополнительные функции, выходящие за рамки их задач в нормальных физиологических условиях, которые могут стимулироваться или усиливаться через lncRNAs и влиять на рост опухоли.