Клиницисты и исследователи объединили усилия, чтобы изучить, как неправильные провоспалительные механизмы способствуют патогенезу эпилепсии, не поддающейся лечению.
Врачи лечат эпилепсию противосудорожными препаратами, чтобы контролировать приступы, но некоторые пациенты не реагируют на эти препараты первой линии терапии. Для пациентов с лекарственно-рефрактерной эпилепсией (ЛРЭ), у которых припадки сохраняются после лечения двумя или более противосудорожными препаратами, врачи вынуждены хирургически удалять часть мозговой ткани, чтобы вылечить это заболевание.
Когда препараты первой линии оказываются неэффективными, ученые изучают молекулярные механизмы болезни, чтобы понять ее причину и разработать альтернативные варианты. В Медицинской школе Duke-NUS клиницисты и исследователи объединили усилия, чтобы изучить, как несоответствующие провоспалительные механизмы способствуют патогенезу ЛРЭ. Эта работа основывается на данных, полученных на животных моделях и результатах резекции мозга пациентов, связывающих воспаление с эпилепсией. Деррик Чан, ученый-клиницист, считает, что это исследование является продолжением его клинической работы. "Это направление стало действительно важным, потому что мы искали менее инвазивный способ попытаться помочь всем детям с лекарственно-устойчивой эпилепсией", - сказал он.
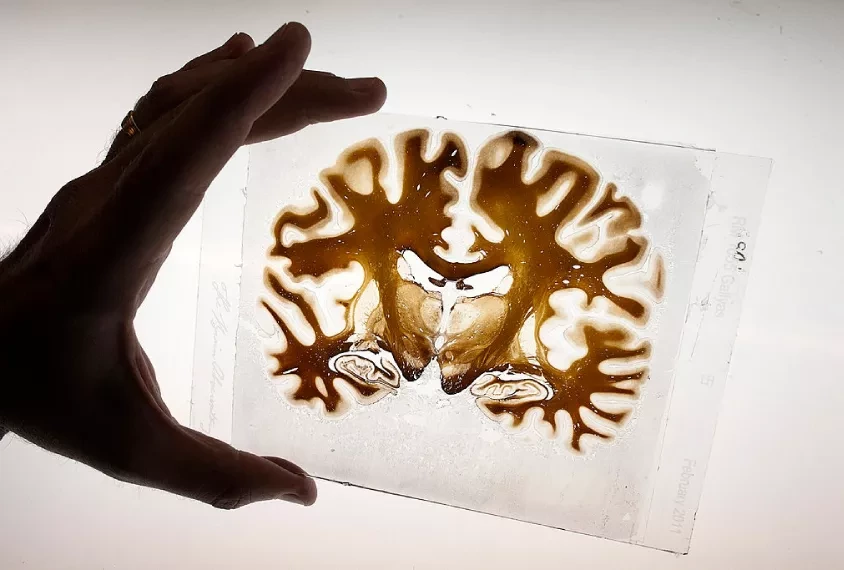
Чан и его команда сотрудничали с группой иммунологов, в которую входил ученый Сальваторе Альбани. В исследовании, опубликованном в журнале Nature Neuroscience, Чан и Альбани описали свои усилия, направленные на понимание иммунологических факторов, способствующих развитию патологии ЛРЭ. Они изучили комплексное участие иммунной системы в эпилептической ткани, которую клиницисты хирургически удаляли у пациентов. Исследователи использовали метод секвенирования единичных клеток под названием клеточная индексация транскриптомов и эпитопов путем секвенирования (CITE-seq), который собирает информацию о РНК и поверхностных белках в единичных клетках. Авторы обнаружили провоспалительное микроокружение в поражениях ЛРЭ, которое напоминает аутоиммунные заболевания мозга, такие как рассеянный склероз.
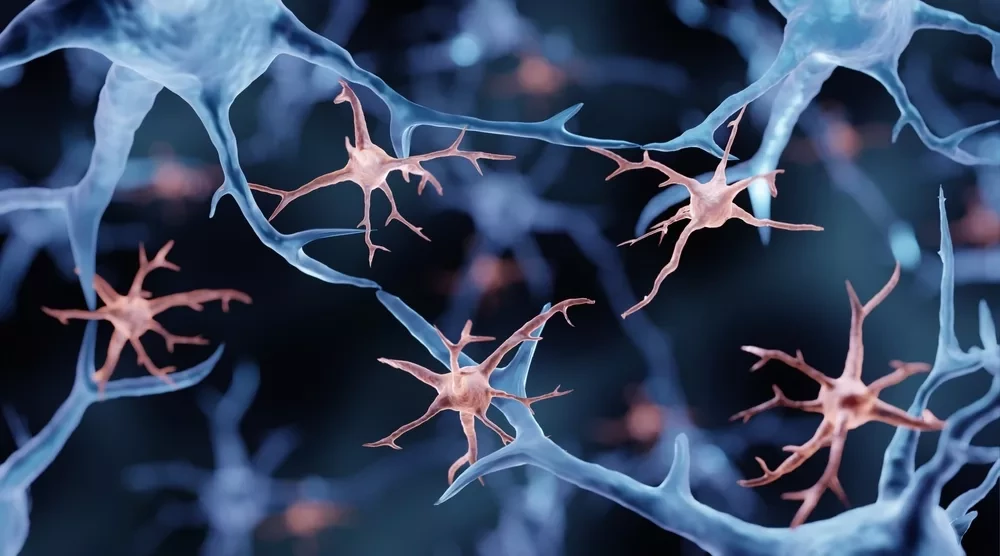
Исследователи определили типы клеток и их функции в поражениях ЛРЭ с разрешением в одну клетку и дифференцировали резидентные клетки мозга и нейрососудистые клетки от проникающих иммунных клеток. Они обнаружили, что микросреда ЛРЭ включает активированную микроглию и другие провоспалительные иммунные клетки, и зафиксировали клеточные взаимодействия с помощью дополнительных молекулярных анализов. "Мы не ожидали такого взаимодействия между микроглией и другими иммунными клетками, а также того, как микроглия становится своего рода стержнем для привлечения всех иммунных клеток, формируя провоспалительную среду внутри мозга", - пояснил Паваниш Кумар, первый автор исследования.
В предыдущей работе Албани и Чан изучали иммунные паттерны в периферической крови пациентов с ЛРЭ. Их предыдущие результаты подчеркнули, как системное воспаление способствует патогенезу эпилепсии, и побудили их изучить местную воспалительную сигнатуру в тканях мозга. Изучение тканей мозга может быть непростой задачей, и, как отметил Альбани, доступ к образцам является одним из ограничений данного исследования. "Не так просто получить ткани мозга от живых пациентов... поэтому количество образцов невелико. Вот почему мы все настаиваем на слове "валидация", - пояснил он. Исследователи подчеркнули, что следующие шаги этой работы будут связаны с использованием животных моделей эпилепсии, чтобы создать прочный фундамент, на который они будут продолжать опираться.
"Это фантастическая научная работа, и это определенно большой скачок вперед в нашей области", - отметил Дэвид Хеншалл, профессор физиологии и медицинской физики в Королевском колледже хирургов в Ирландии, который не принимал участия в исследовании. "С точки зрения исследования эпилепсии нет никаких аргументов в пользу того, что в этой форме эпилепсии с лекарственной устойчивостью есть иммунный компонент... Возможно, теперь, основываясь на этом исследовании, мы сможем разработать терапию или комбинацию терапий, которые могут быть более точными, чем те, что были опробованы до сих пор".
Действительно, исследователи надеются найти менее инвазивные методы лечения ЛРЭ, например, перепрофилированные биологические препараты, которые безопасны и эффективны при иммунологических заболеваниях. Чан также отмечает, что исследования эпилепсии могут пролить свет на роль воспаления в других неврологических заболеваниях. "Я думаю, что мы находимся в уникальном положении. Как эпилептологи, мы имеем доступ к тканям мозга". Это контрастирует с другими неврологическими заболеваниями, такими как рассеянный склероз, для которых образцы, отражающие ранние и высокоактивные стадии болезни, ограничены. Таким образом, эти результаты могут иметь последствия не только для исследований эпилепсии.
Pavanish Kumar et al. Транскриптомика единичных клеток и обнаружение поверхностных эпитопов в эпилептических поражениях мозга человека выявляет провоспалительную сигнализацию (аннотация).
Эпилептогенные триггеры являются многофакторными и недостаточно изученными. В данном исследовании мы стремились рассмотреть гипотезу о том, что несоответствующие провоспалительные механизмы вносят вклад в патогенез рефрактерной эпилепсии (невосприимчивости к противоэпилептическим препаратам) у пациентов. Мы использовали метод секвенирования одноклеточного клеточного индексирования транскриптомов и эпитопов (CITE-seq) для выявления иммунотранскриптома хирургически резецированных тканей эпилептического поражения. Наш подход выявил провоспалительную микросреду, включая обширную активацию микроглии и инфильтрацию другими провоспалительными иммунными клетками. Эти выводы были подтверждены анализом лиганд-рецепторного (LR) интерактома, который продемонстрировал потенциальные механизмы инфильтрации и доказательства прямого физического взаимодействия между микроглией и Т-клетками. В целом эти данные дают представление об иммунном микроокружении в эпилептической ткани, что может помочь в разработке новых терапевтических средств.