Третичные лимфоидные структуры - это образования, расположенные вне лимфатической системы.
Они содержат иммунные клетки и по структуре и функции сходные с лимфатическими узлами и другими лимфоидными структурами. Однако о том, как формируются третичные лимфоидные структуры, известно мало. В новой статье, опубликованной в журнале Immunity, исследователи Онкологического центра Моффитта сообщают о молекулярных и клеточных механизмах, которые контролируют формирование третичных лимфоидных структур в опухолях.
Иммунная система состоит из различных типов клеток и выделяемых ими белков, которые регулируют развитие рака, включая Т-клетки и В-клетки. Т-клетки также делятся на категории в зависимости от их функций и специфических молекул, которые они экспрессируют, например, Т-фолликулярные хелперы (Tfh) и Т-фолликулярные регуляторные (Tfr) клетки. Взаимодействие между этими различными иммунными клетками может либо способствовать, либо препятствовать развитию рака. Tfh-клетки стимулируют В-клетки к выработке антител, а Tfr-клетки подавляют эту активность. Tfh и Tfr клетки и другие иммунные клетки обнаруживаются в лимфатических узлах, а также в третичных лимфоидных структурах.
В ряде исследований были обнаружены более благоприятные исходы у пациентов с опухолями, имеющими третичные лимфоидные структуры, включая более эффективный ответ на иммунотерапию. Предполагается, что наличие активных иммунных клеток в третичных лимфоидных структурах и секретируемые ими белки способствуют иммунной активности против опухолевых клеток. Однако неясно, как формируются третичные лимфоидные структуры, особенно потому, что они редко обнаруживаются в экспериментальных моделях мышей.
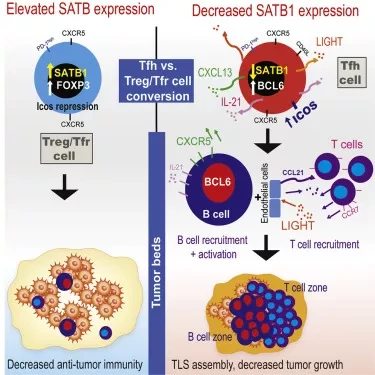
Исследователи провели серию лабораторных экспериментов с клетками и моделями мышей, чтобы улучшить понимание молекулярных и клеточных механизмов, которые приводят к формированию третичных лимфоидных структур. Они обнаружили, что белок SATB1 является важным регулятором процесса дифференцировки клеток Tfh и Tfr. SATB1 - это геномный организующий белок, который помогает контролировать плотность упаковки ДНК и служит рекрутером для других модифицирующих белков. Исследователи обнаружили, что подавление экспрессии SATB1 способствует процессу дифференцировки клеток Tfh и предотвращает образование клеток Tfr. Они также определили некоторые из ключевых сигнальных молекул, участвующих в этом процессе, включая ICOS и TGF-β.
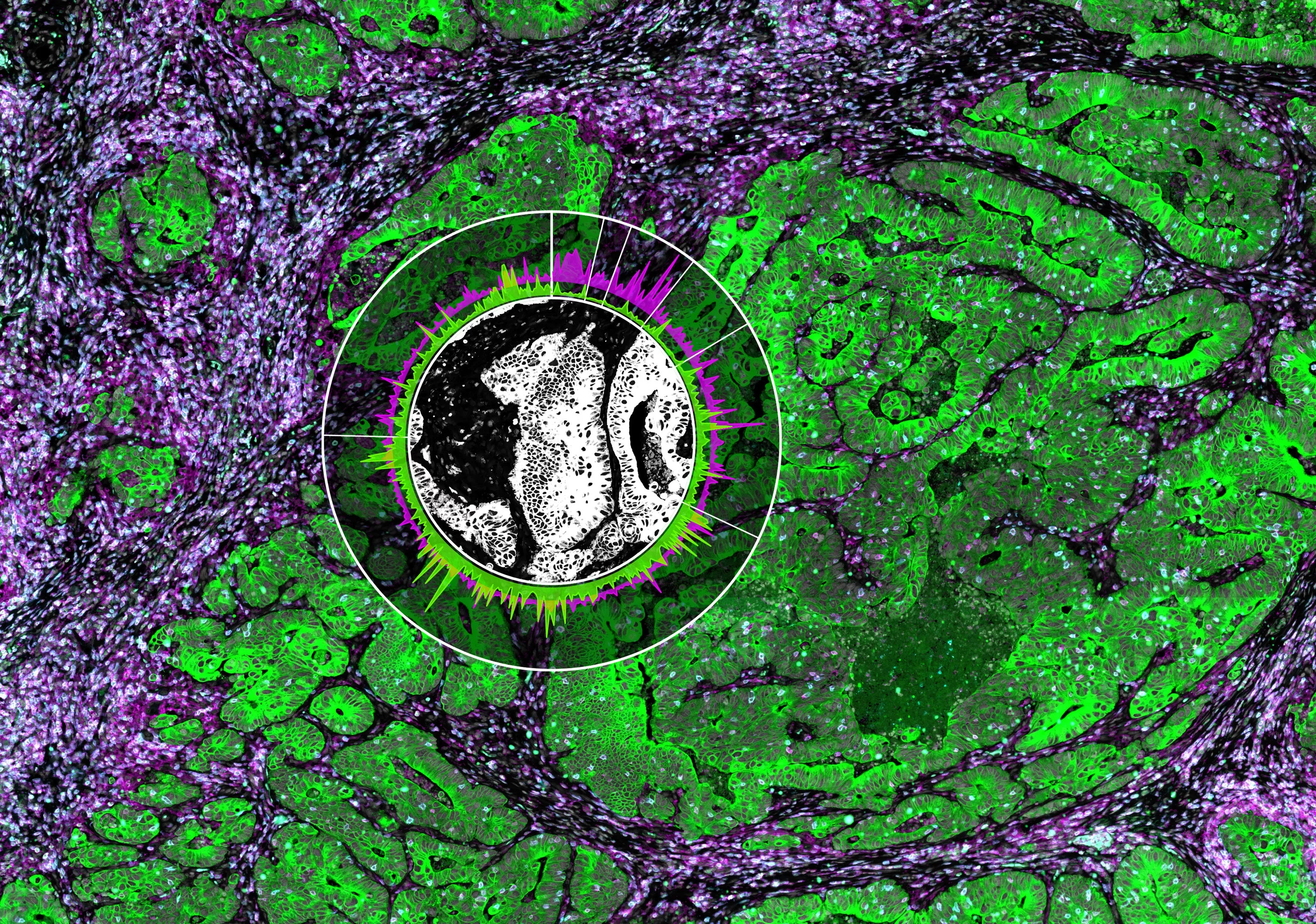
Ученые подтвердили важность SATB1 для этого процесса, показав, что у мышей с Т-клетками, лишенными SATB1, была более высокая доля Tfh-клеток, способных взаимодействовать с В-клетками и формировать третичные лимфоидные структуры в опухолях. Важно отметить, что исследователи также показали, что опухоли росли меньше у мышей, которым вводили Tfh-клетки, по сравнению с контрольными T-клетками, что было связано с образованием третичных лимфоидных структур в опухолях. Исследователи надеются, что их выводы приведут к новым методам воздействия на третичные лимфоидные структуры в нерезектабельных опухолях для поддержки противораковой иммунотерапии.
"Третичные лимфоидные структуры встречаются примерно в 20% раковых опухолей человека. Используя данные нашего исследования, мы полагаем, что интратуморальное введение аутологичных антигенспецифических Tfh-клеток в метастатические раковые опухоли или нерезектабельные опухоли может способствовать образованию третичных лимфоидных структур".
"Противоопухолевые Т-клетки, обнаруженные в этих третичных лимфоидных структурах, могут обеспечить защитную нишу для оказания иммунного давления против прогрессирования злокачественных опухолей и, возможно, повысить успех иммунотерапии",
- сказал Хосе Конехо-Гарсия, заведующий отделением иммунологии Онкологического центра Моффитта.
Ricardo A. Chaurio et al. TGF-β-опосредованный сайленсинг геномного организатора SATB1 способствует дифференцировке Tfh-клеток и формированию интратуморальных третичных лимфоидных структур (аннотация).
Иммунный рецептор PD-1 на фолликулярных хелперных (Tfh) клетках способствует взаимодействию Tfh:B-клеток и соответствующему расположению в тканях. В данном исследовании мы изучили влияние регуляции экспрессии PD-1 геномным организатором SATB1 на дифференцировку Tfh-клеток. Вакцинация мышей CD4CreSatb1f/f обогатила антиген-специфические Tfh клетки, а TGF-β-опосредованная репрессия SATB1 усилила дифференцировку Tfh клеток человека.
Механистически, высокая экспрессия Icos в Satb1-/- CD4+ Т-клетках способствовала дифференцировке Tfh-клеток, предотвращая отклонения фолликулярных регуляторных клеток T, и приводила к увеличению изотип-сдвинутых В-клеточных ответов in vivo. Опухоли яичников у мышей CD4CreSatb1f/f накапливали опухолевые антиген-специфические, LIGHT+CXCL13+IL-21+ Tfh-клетки и третичные лимфоидные структуры (TLS). Образование TLS уменьшало рост опухоли в зависимости от CD4+ Т-клеток и CXCL13. Передача Tfh-клеток, но не наивных CD4+ Т-клеток, индуцировала образование TLS в опухолевых ложах и уменьшала рост опухоли.
Таким образом, TGF-β-опосредованный сайленсинг Satb1 лицензирует дифференцировку Tfh-клеток, что позволяет понять генез TLS в опухолях.