Противовирусный иммунный рецептор RIG-I может быть стимулирован, что повышает защиту от смертельных инфекций SARS-CoV-2.
Исследователи под руководством проф. Гюнтера Хартманна из Института клинической химии и клинической фармакологии Университетской клиники Бонна доказали это на мышах. Кроме того, было отмечено значительное снижение частоты развития тяжелых форм заболевания. Исследование было опубликовано в журнале Molecular Therapy - Nucleic Acids.
Продолжающаяся пандемия SARS-CoV-2 вызвала острую потребность как в противовирусных терапевтических препаратах, так и в вакцинах. В то время как разработка вакцин была осуществлена в удивительно короткие сроки, определение прямых противовирусных препаратов продвигалось сравнительно медленно. Однако в свете дальнейшего риска пандемий в будущем потребность в прямых противовирусных препаратах и методах лечения сохраняется. Более того, вызывают беспокойство новые иммуноэвазивные, то есть маскирующиеся от иммунной системы, варианты SARS-CoV-2. Они вызывают большое количество инфекций даже среди высоко иммунизированного населения, что подчеркивает постоянную потребность в эффективных противовирусных препаратах для лечения COVID-19.
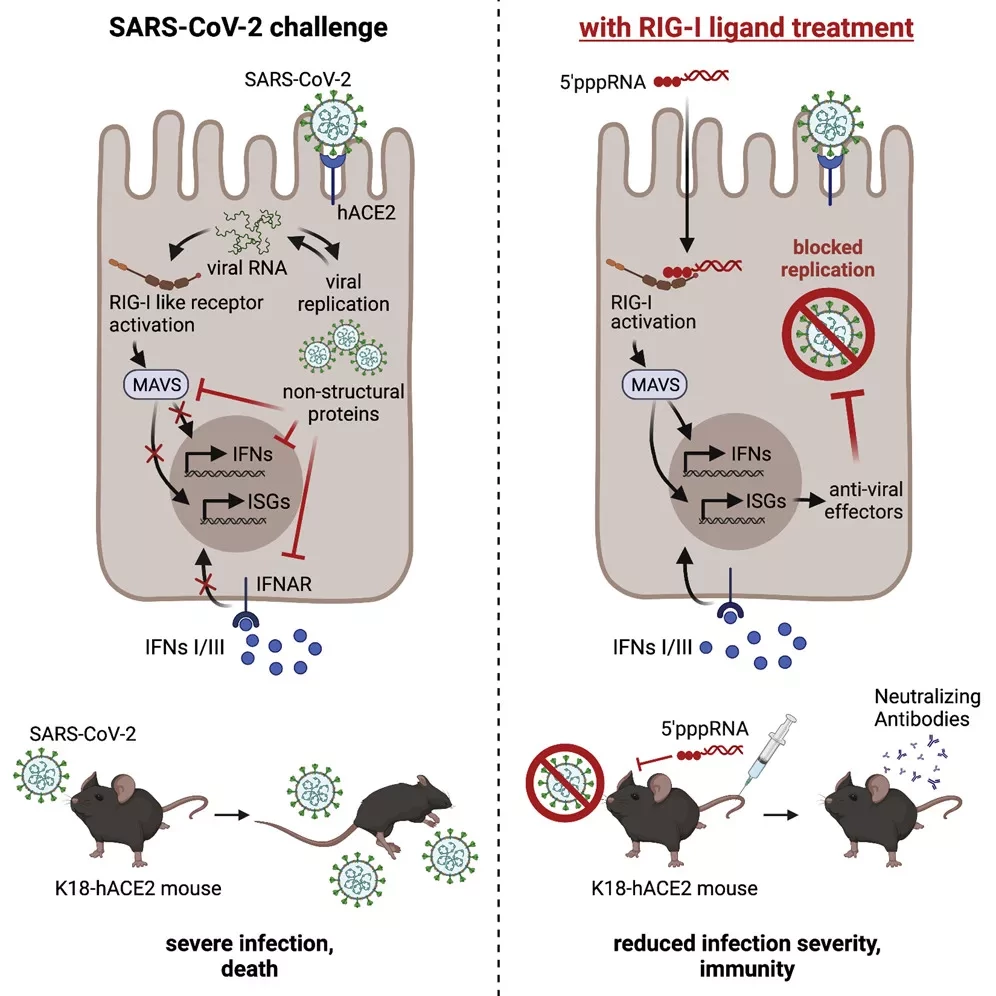
SARS-CoV-2 принадлежит к роду Betacoronavirus. Как и другие представители этого рода, SARS-CoV-2 оснащен несколькими молекулярными инструментами, которые позволяют ему уклоняться от распознавания иммунной системой. Вирус несет в себе информацию для производства ряда белков, способных подавлять противовирусные системы распознавания инфицированной клетки. Фактически, эти системы могут распознавать вирусный генетический материал (здесь: рибонуклеиновые кислоты/РНК) и бить тревогу. Белки SARS-CoV-2 могут изменять вирусные рибонуклеиновые кислоты таким образом, что они становятся неотличимыми от эндогенной РНК.
Например, вирусные РНК маскируются путем добавления метильной группы. Таким образом, вирусная РНК избегает раннего распознавания центральным противовирусным иммунорецептором RIG-I. Этот рецептор обычно вызывает так называемый врожденный иммунный ответ, в ходе которого вырабатываются противовирусные активные белки, клеточные сигналы и вещества-посланники, такие как интерферон I типа (IFN).
"Устойчивая, ранняя выработка IFN I типа является ключом к очищению от инфекции SARS-CoV-2. Его отсутствие связано с прогрессированием заболевания и развитием тяжелой формы COVID-19", - поясняет Хартманн. "Активация врожденного противовирусного ответа, включая высвобождение IFN I и III типа, также чрезвычайно важна для развития соответствующего противовирусного адаптивного иммунного ответа. Адаптивный иммунный ответ возникает только через несколько дней и включает в себя активацию других иммунных клеток и, в конечном итоге, выработку антител".
Иммунный рецептор RIG-I ранее был идентифицирован как подходящая мишень для профилактического запуска противовирусных эффектов. Например, на мышиных моделях было показано, что профилактическая стимуляция RIG-I может защитить мышей от летальной инфекции вируса гриппа. "Такие РНК, стимулирующие RIG-I, которые имитируют вирусную РНК, могут быть химически синтезированы и использованы в качестве терапевтических средств для включения врожденного иммунного ответа против многочисленных заболеваний, включая рак и вирусные инфекции", - говорит Хартманн.
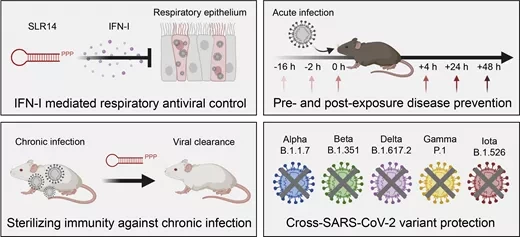
В настоящем исследовании ученые проанализировали влияние синтетической 5'трифосфорилированной дсРНК (3pRNA) на течение инфекции SARS-CoV-2 в мышиной модели. Поскольку мыши обычно не восприимчивы к SARS-CoV-2, исследователям пришлось использовать генетически адаптированных мышей, способных генерировать связывающий SARS-CoV-2 ангиотензин-конвертирующий фермент 2 (ACE2). "Использованная нами мышиная модель повторяет ключевые аспекты человеческого заболевания COVID-19", - добавляет Хартманн.
Используя эту модель, исследователи смогли показать, что системное применение 3pRNA за один-семь дней до инфицирования SARS-CoV-2 резко снижает долю летальных случаев. Аналогичное наблюдение было сделано и при терапевтическом применении 3pRNA через день после заражения.
"Наши результаты ясно показывают, что нацеливание на RIG-I, как в профилактическом, так и в терапевтическом плане, является перспективным подходом в лечении COVID-19. Однако перед применением на людях необходимо провести дополнительные исследования",
- резюмирует Хартманн.
Samira Marx et al. RIG-I-индуцированный врожденный противовирусный иммунитет защищает мышей от летальной инфекции SARS-CoV-2 (аннотация).
Пандемия SARS-CoV-2 подчеркнула необходимость в быстродействующих профилактических и противовирусных средствах против новых вирусов. Целенаправленная стимуляция противовирусных рецепторов врожденного иммунитета может вызвать широкий противовирусный ответ, который также действует против новых, неизвестных вирусов. В данном исследовании мы использовали мышиную модель COVID-19 K18-hACE2 для изучения того, защищает ли активация противовирусного РНК-рецептора RIG-I мышей от летальной инфекции SARS-CoV-2 и снижает ли тяжесть заболевания. Мы обнаружили, что профилактическое системное лечение мышей специфическим лигандом RIG-I 3pRNA, но не интерфероном I типа, за 1-7 дней до вирусной инфекции, повышает выживаемость мышей на 50%. Выживаемость также улучшилась при терапевтическом лечении 3pRNA, начатом через 1 день после вирусной инфекции. Улучшение результатов было связано со снижением вирусной нагрузки в ротоглоточных мазках, легких и мозге мышей, получавших 3pRNA. Кроме того, у мышей, обработанных 3pRNA, уменьшилось воспаление легких и развился специфический для SARS-CoV-2 нейтрализующий ответ антител.
Эти результаты показывают, что системная активация RIG-I терапевтическими олигонуклеотидными агонистами РНК является перспективной стратегией для обеспечения эффективной, краткосрочной противовирусной защиты от инфекции SARS-CoV-2 и имеет большой потенциал в качестве подхода широкого спектра действия для сдерживания распространения вновь появляющихся вирусов до появления вирусоспецифической терапии и вакцин.