В недавнем исследовании, опубликованном в журнале Immunity, ученые провели обзор научных достижений, свидетельствующих о значительной роли врожденной и адаптивной иммунных систем в патологическом течении болезни Альцгеймера (БА).
Исследования показали, что "иммунопривилегированное" состояние гомеостатической паренхимы мозга является условным и демонстрирует изменчивость на уровне отдельных областей. Нерезидентные иммунные клетки могут проникать, в частности, в пограничные области центральной нервной системы (ЦНС) и формировать потенциальную связь с клеточными популяциями внутри паренхимы. Мозг обнаруживает и реагирует на эти нарушения, поддерживая функцию нейронов посредством иммунологической защиты. При нейродегенеративных заболеваниях, таких как БА, происходят сложные изменения во врожденном и адаптивном иммунитете.
БА, открытая в 1907 году, патологически характеризуется региональной атрофией мозга с соответствующей потерей нейронов и синапсов, что, вероятно, объясняет когнитивные изменения. БА также является нарушением агрегации белков, в основном амилоида-β (Aβ) и ассоциированного с микротрубочками белка тау. Агрегация Aβ и тау впоследствии повреждает синапсы, процессы в нейронах и гематоэнцефалический барьер (ГЭБ), что, в свою очередь, способствует проникновению периферических иммунных клеток в мозг. Хотя БА не является аутоиммунным заболеванием, в паренхиме мозга при БА происходят изменения в иммунной среде, т.е. резкие изменения в инфраструктуре врожденной и адаптивной иммунной системы.
Основные механизмы, определяющие клинически симптоматическую фазу БА, до сих пор остаются невыясненными. Несколько ключевых регуляторов путей врожденного иммунитета являются генетическими факторами риска развития БА. Данные исследований in vivo указывают на роль микроглии; кроме того, появляются новые доказательства того, что адаптивный иммунитет играет решающую роль в патогенезе БА.
Таким образом, очень важно определить взаимосвязь между врожденной и адаптивной иммунными системами, особенно микроглией и Т-клетками, в зависимости от состояния заболевания. Понимание того, как эти клетки взаимодействуют, экспрпредставляют антигены и их патофизиологические реакции, может помочь найти уникальные терапевтические вмешательства для профилактики, лечения или обратного развития нейродегенерации как на доклинической, так и на клинической стадии БА.
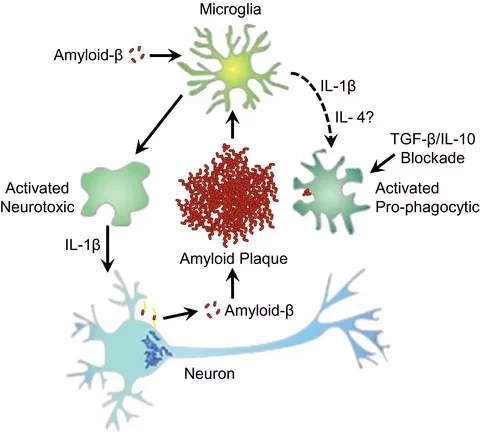
Мониторинг изменений состояния микроглии, включая микроглию, ассоциированную с заболеванием (DAM), активированную микроглию (ARM) и микроглию, реагирующую на повреждение (IRM), может помочь в разработке специфических соединений, направленных на нейротоксичность и воспалительные пути, опосредованные микроглией, и может послужить способом определения стадии БА и разработки стратегий для замедления или прекращения прогрессирования БА. Примечательно, что микроглия непосредственно выделяет цитокины и, вероятно, опосредует разрушение синапсов через сигнальные пути, связанные с врожденным иммунитетом.
Визуализация in vivo у мышей с помощью флуоресцентно меченных антител Ly6C/G показала, что нейтрофилы проникают в паренхиму мозга и мигрируют к амилоидным бляшкам. Их миграция в паренхиму опосредована лейкоцитарным функционально ассоциированным антигеном-1 (LFA-1), зависящим от интегринов. Однако остается неясным, являются ли инфильтрирующие моноциты или моноцитарные макрофаги полезными или вредными для Aβ- или тау-связанных патологий. Кроме того, несмотря на накопление генетических и функциональных доказательств, остается неясным, является ли благотворная и пагубная роль адаптивного иммунитета в патогенезе БА прямой или косвенной.
Аполипопротеин Е (ApoE) - это липопротеин, экспрессия которого значительно повышается в иммунных клетках, особенно в микроглии и макрофагах, особенно в условиях заболевания. Многочисленные исследования показали, что ApoE является самым сильным генетическим фактором риска развития поздней стадии болезни Альцгеймера (LOAD). Недавний случай показал, что человек с двумя копиями мутации ApoE3 R136S был относительно устойчив к когнитивному снижению вследствие аутосомно-доминантной БА.
Однако механизм, лежащий в основе этого эффекта, неясен. Исследования на трансгенных животных также повторили клинические наблюдения и подтвердили, что ApoE сильно влияет на отложение Aβ, тау-опосредованную нейродегенерацию и другие фенотипы, такие как дисфункция ГЭБ, презентация антигенов и активация Т-клеток. При спорадических тауопатиях у лиц, несущих аллель ApoE4, наблюдалась более выраженная нейродегенерация при наличии аналогичного количества патологического тау.
Как и ApoE, триггерный рецептор, экспрессируемый на миелоидных клетках 2 (Trem2), демонстрирует потенциальную двойную роль для DAM и прогрессирования заболевания в контексте формирования амилоидных бляшек и опосредованной патологией тау атрофии мозга. Этот белок является членом иммуноглобулинового суперсемейства рецепторов, экспрессируемых в макрофагах и микроглии, что подчеркивает его потенциальную роль в иммунной модуляции. Одиночные аминокислотные различия на определенных участках, такие как R47H у людей, связаны с двух-четырехкратным увеличением риска развития БА. Эти мутации также связаны со снижением функции TREM2.
Пути комплемента и их клиренсовые функции повышают риск развития БА. Например, в мышиной модели J20, выделяющей Аβ, C1q, инициирующий белок классического каскада комплемента, был увеличен и связан с синапсами до явного отложения бляшек, что, по-видимому, способствовало потере синапсов. Поскольку открыто активированные пути комплемента являются отличительной чертой и движущей силой Aβ- и тау-опосредованной нейродегенерации при БА, их ослабление может ограничить этот процесс.
Адаптивный иммунитет является важным компонентом в патогенезе Аβ. Помимо прямого воздействия на жизнеспособность нейронов, адаптивный иммунитет также влияет на патологию и взаимодействует с врожденным иммунитетом, который, в свою очередь, может влиять на нейродегенерацию.
В нескольких исследованиях было обнаружено увеличение количества Т-клеток в ЦСЖ, лептоменинге и гиппокампе в посмертных тканях пациентов с БА, а также в моделях мышей с Aβ и tau. Было отмечено преобладание CD8+, а не CD4+ Т-клеток. Большее количество Т-клеток располагалось в гиппокампе и других лимбических структурах с более тяжелой патологией у пациентов с БА, что указывает на тесную связь между повреждением нейронов и накоплением Т-клеток.
В гомеостатических условиях регуляторные и эффекторные Т-клетки взаимодействуют с микроглией, вместе с выделяемыми ею противо- или провоспалительными цитокинами, включая интерферон-гамма (IFN-γ). При БА микроглия продуцирует цитокины, нейротоксичные реактивные формы кислорода (ROS) и индуцибельную синтазу оксида азота (iNOS), что приводит к нейровоспалительному каскаду в паренхиме мозга, который может привести к вторжению Т-клеток, а активированные Т-клетки выделяют нейротоксичные медиаторы, ускоряющие атрофию мозга.
Вопрос о том, может ли сигнализация IFN-γ служить потенциальной терапевтической мишенью путем нейтрализации IFN-γ или генетической или манипуляции его рецептора в конкретных типах клеток, таких как микроглия и нейроны, требует дальнейших исследований. Таким образом, роль адаптивного иммунитета при тауопатии и нейродегенерации вместе с иммунным микроокружением в паренхиме мозга требует изучения. У мышей APP/PS1, трансгенных мышей, экспрессирующих химерный белок-предшественник амилоида мыши/человека, старение, диабет, циркадный ритм, дисфункция сна и микробиота кишечника оказались факторами риска развития БА.
Согласованная деятельность эффекторов врожденного и адаптивного иммунитета имеет решающее значение для формирования адекватного иммунного ответа в совершенно новой иммунной среде, наблюдаемой у пациентов с БА. Взаимодействие этих двух звеньев иммунитета способствует развитию и прогрессированию БА. Таким образом, врожденные и адаптивные иммунные реакции в паренхиме мозга и на его периферии могут стать ключевым звеном для создания терапевтических мишеней для лечения как досимптоматических, так и симптоматических стадий БА.
Xiaoying Chen et al. Роли врожденного и адаптивного иммунитета при болезни Альцгеймера (аннотация).
Болезнь Альцгеймера (БА) является наиболее распространенным нейродегенеративным заболеванием, для которого характерно внеклеточное отложение амилоида-β (Aβ) и внутриклеточное накопление гиперфосфорилированного, агрегированного тау. Несколько ключевых регуляторов путей врожденного иммунитета являются генетическими факторами риска развития БА. Хотя эти генетические факторы риска, а также данные in vivo указывают на ключевую роль микроглии, появляющиеся данные также указывают на роль адаптивного иммунного ответа в патогенезе заболевания.
Мы рассматриваем роль врожденного и адаптивного иммунитета, их ниши, их взаимодействие и их вклад в развитие и прогрессирование БА. Мы также кратко описываем клеточный состав и физиологические функции иммунных клеток в паренхиме, а также в пограничных структурах мозга, которые образуют динамическую иммунную нишу, связанную с заболеванием. Мы предполагаем, что врожденные и адаптивные иммунные реакции в паренхиме мозга и пограничных структурах могут служить важными терапевтическими мишенями для лечения как предсимптоматических, так и симптоматических стадий БА.