Врожденный иммунитет реагирует на проникновение вирусов в клетку хозяина, что имеет решающее значение для противовирусной защиты хозяина путем индуцирования интерферона, воспалительных цитокинов и хемокинов.
Быстрый и эффективный ответ врожденного иммунитета важен для ограничения вирусной репликации и активации вирусоспецифического адаптивного иммунного ответа. Однако чрезмерная выработка провоспалительных цитокинов и хемокинов (например, IL-6, IL-8, IL-1, CXCL10/IP10 и TNFα) играют ключевую роль в патогенезе КОВИДD-19 у инфицированных пациентов. Поэтому актуально и важно исследовать факторы и сигнальные пути, способствующие иммунному ответу клеток хозяина на инфекцию SARS-CoV-2.
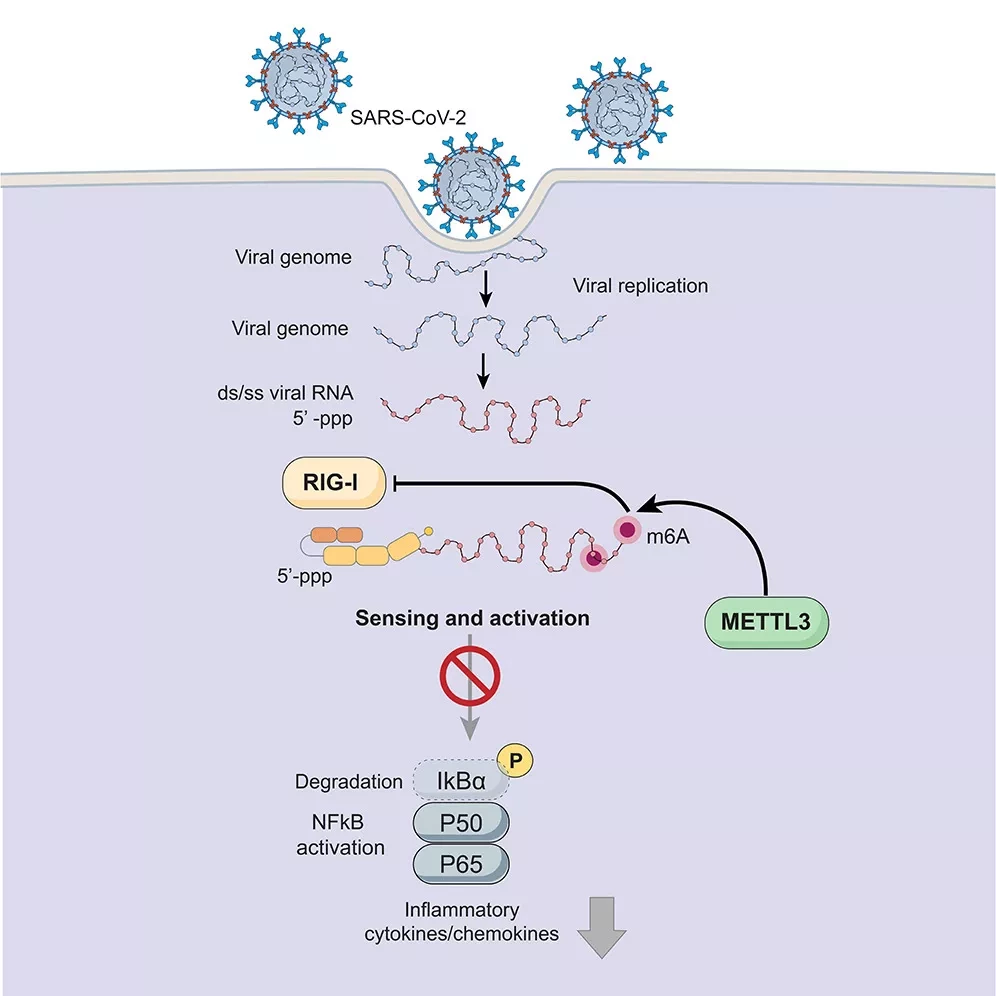
Исследователи из Медицинской школы Калифорнийского университета в Сан-Диего обнаружили один из способов, с помощью которого SARS-CoV-2 захватывает человеческие клетки, чтобы ослабить иммунный ответ. Коротко говоря, геном вируса помечается специальным маркером с помощью человеческого фермента, который приказывает иммунной системе отступить, одновременно увеличивая производство поверхностных белков, которые SARS-CoV-2 использует в качестве "дверной ручки" для проникновения в клетки.
Опубликованное в Cell Reports исследование, помогает заложить основу для новых антивирусных иммунотерапий - методов лечения, которые работают за счет усиления иммунной системы пациента, а не прямого уничтожения вируса.
"Очень умно со стороны этого вируса использовать механизмы хозяина, чтобы одновременно перейти в скрытый режим и проникнуть в большее количество клеток", - говорит соавтор работы Тарик Рана. "Чем больше мы знаем о том, как вирус закрепляется в организме, тем лучше мы подготовлены к его уничтожению".
В клетках человека гены (ДНК) транскрибируются в РНК, которая затем транслируется в белки. Но не всегда все так просто. Клетки могут химически модифицировать РНК, чтобы повлиять на производство белка. Одной из таких модификаций является добавление метильных групп к аденозину, одному из строительных блоков, из которых состоит РНК. Эта модификация, известная как N6-метиладенозин (m6A), широко распространена у людей и других организмов, включая вирусы.
Поскольку геномы многих вирусов, включая SARS-CoV-2, состоят из РНК, а не из ДНК, вместо того, чтобы иметь собственные механизмы для преобразования РНК в белки, коронавирус поручает эту работу человеческим клеткам. Рана и его коллеги ранее обнаружили, что m6A играет важную роль при инфекциях ВИЧ, вируса Зика и регулирует многие физиологические и патологические процессы.
В своем последнем исследовании ученые обнаружили, что человеческий фермент METTL3 добавляет метильные группы для внедрения m6A в РНК SARS-CoV-2. Эта модификация не позволяет РНК вируса запускать цитокины. К удивлению ученых, активность METTL3 также привела к увеличению экспрессии провирусных генов - тех, которые кодируют белки, необходимые для репликации и выживания SARS-CoV-2, такие как ACE2, рецептор клеточной поверхности, который вирус использует для проникновения в клетки человека. "Еще предстоит выяснить, почему наши клетки так помогают вирусу", - говорит Рана.
Когда исследователи удаляли METTL3 из клеток в лаборатории, используя сайленсинг генов или другие методы, они наблюдали обратное - провоспалительная молекула, известная как RIG1, связывала вирусную РНК, вырабатывалось больше воспалительных цитокинов, а провирусные гены подавлялись. В конечном итоге, ингибирование METTL3 подавляло вирусную репликацию.
Чтобы увидеть, как этот механизм работает в реальности, исследователи сравнили посмертные образцы легких пациентов с КОВИД-19 и биопсии здоровых легких. Было обнаружено, что у пациентов, умерших от тяжелой формы КОВИД-19, экспрессия METTL3 была ниже, а уровень воспалительных генов - выше. По словам Рана, это имеет место на поздних стадиях КОВИД-19, поскольку известно, что цитокиновый шторм - чрезмерная активация собственной иммунной системы пациента - ухудшает течение болезни.
"Это похоже на две фазы инфекции - на первой вирус нуждается в METTL3, чтобы помочь ему уклониться от иммунного ответа", - сказал он, - "но на второй фазе, когда вирус размножается как сумасшедший, эффективнее подавить METTL3".
Сейчас группа Рана подтверждает свои выводы на животных моделях и разрабатывает ингибиторы METTL3 для тестирования в качестве потенциальных экспериментальных методов лечения КОВИД-19.
"Мы надеемся, что, манипулируя уровнем m6A в вирусе, мы сможем изменить время врожденного иммунного ответа таким образом, что это принесет пользу пациентам с КОВИД-19, особенно пациентам с легкой или средней степенью тяжести, у которых не развился цитокиновый шторм", - говорит Рана. "Проблема в том, что в клетках есть много других ферментов, поэтому ингибировать их нужно будет очень специфически, в определенное время".
Полученные результаты позволят глубже понять патогенез КОВИД-19 и помогут в разработке будущих исследований по регулированию врожденного иммунитета.