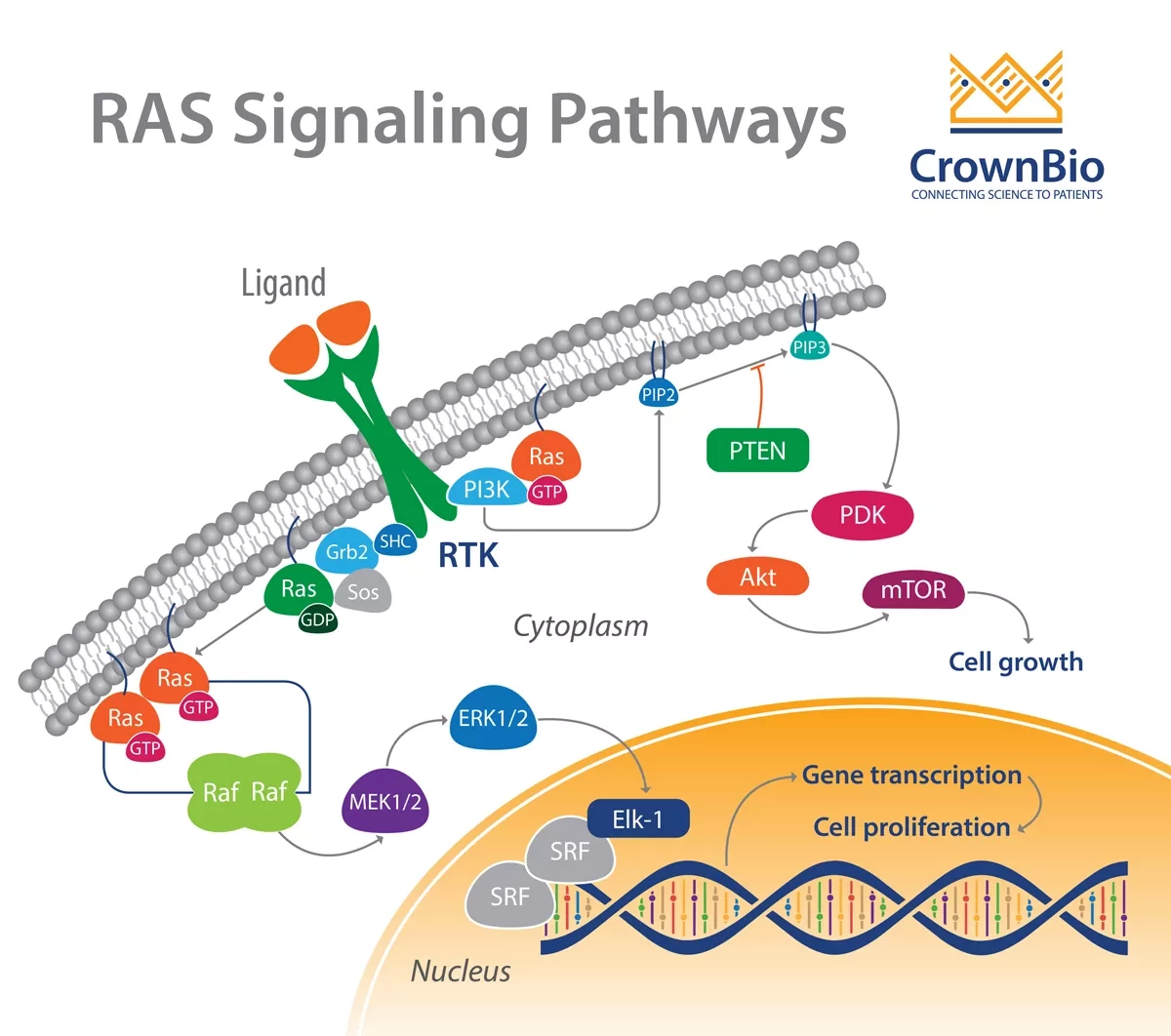
IgA регулирует активность иммунных клеток, ингибируя RAS-сигнализирование и распознавание опухолевых маркеров.
Прогноз развития рака яичников неудовлетворителен: по оценкам, пятилетняя выживаемость для прогрессирующего заболевания составляет лишь 40%, т.е. на этой стадии диагностируется большинство карцином яичников. Эти плохие результаты частично объясняются отсутствием эффективной терапии прогрессирующих заболеваний и рецидивов. Иммунотерапия многообещающа для многих видов рака; однако исследования показали, что пациенты с раком яичников не имеют выраженной реакции на существующие препараты. В новой статье, опубликованной в журнале Nature, исследователи онкологического центра Моффитта демонстрируют, почему некоторые больные раком яичников пролечиваются лучше, чем другие, и предлагают возможные подходы для улучшения результатов терапии пациентов.
Иммунотерапевтические препараты активируют Т-клетки, иммунотерапия одобрена для лечения нескольких различных типов рака и значительно изменила стандарт лечения и улучшила исходы пациентов. Однако при раке яичников клинические исследования с использованием иммунотерапии, направленные на стимулирование Т-клеток, привели к скромным показателям. Исследования показали, что онкологические пациенты, которые имеют более высокое присутствие других иммунных клеток, таких как В клетки, могли бы лучше реагировать на иммунотерапию, но как эти типы клеток способствуют улучшению результатов неясно. Исследователи хотели установить, ассоциируются ли антитела, вырабатываемые этими клетками, с лучшими результатами, и оценить, как эти клетки способствуют спонтанному противоопухолевому иммунному ответу против рака яичников.
Была проанализирована панель из 534 образцов, взятых у больных раком яичников, и обнаружено, что у пациентов с более высокой инфильтрацией B-клеток или B-клеток плазмы, результаты были лучше. B-клетки - это тип иммунной клетки, которая вырабатывает антитела и экспрессирует один из пяти типов B-клеточных рецепторов на своей поверхности: IgM, IgD, IgG, IgE или IgA. Эти изотипы регулируют различные сигнальные пути B-клеток и контролируют B-клеточные процессы. Удивительно, что после дальнейшего анализа образцов группа обнаружила, что антитела, вырабатываемые В и плазменными клетками, в основном относятся к подтипу IgA, за которым следует подтип IgG.
"Мы обнаружили, что наличие IgA регулирует нисходящие сигнальные пути раковых клеток яичников. В частности, IgA привело к ингибированию сигнального пути RAS, который, как известно, способствует развитию рака яичников", - говорит соавтор статьи Хосе Конехо-Гарсия.
Это RAS ингибирование сенсибилизировало опухолевые клетки к опосредованному Т-клеточному уничтожению клеток, производимому как новыми CAR T-клетками, так и лимфоцитами, инфильтрирующими опухоль. Ученые также установили, что IgA и IgG, секретируемые В-клетками, распознают специфические маркеры поверхности опухолевых клеток яичников и стимулируют нацеливание миелоидных клеток на уничтожение раковых клеток яичников.
Эти данные дают новое представление о том, как компоненты иммунной системы регулируют прогрессирование рака яичников и предлагают новые возможности для разработки улучшенных целевых агентов. Сюда входит спектр антител, полученных из опухолей, которые могут быть эффективно использоваться в качестве новых иммунотерапевтических средств. Кроме того, исследование предоставляет обоснование разработки новых иммунотерапевтических препаратов, которые до сих пор базировались на Т-клеточно-ориентированном подходе.
"Результаты показывают, что иммунотерапия, которая усиливает скоординированные реакции В и Т-клеток против рака яичников, иммуногенного заболевания, которое в настоящее время резистентно к чекпойнт ингибиторам, скорее всего, покажет превосходное терапевтическое преимущество", - говорит Субир Бисвас, первый автор исследования.