В ходе лабораторных экспериментов с изучением класса мутаций у людей с редким типом нарушения иммунной системы исследователи из Johns Hopkins Medicine сообщают, что им удалось выяснить новые подробности того, как клетки иммунной системы реагируют на вызывающие заболевания бактерии, грибки и вирусы, такие как SARS-CoV-2.
Полученные данные, как сообщают ученые, раскрывают критический шаг в механизме молекулярной схемы В- и Т-клеток, которые мобилизуют иммунную систему для борьбы с инородными захватчиками. Хотя исследователи изучали редкие мутации, они считают, что полученные результаты указывают на тонкие генетические вариации среди всех человеческих популяций, которые могут помочь объяснить широкую вариативность индивидуальных реакций на инфекции.
Опубликованные в журнале iScience результаты исследователи посвятили изучению клеточной биологии и генетики трех наследственных заболеваний, классифицируемых как первичные синдромы иммунодефицита, которые вызываются мутациями в гене CARD11 в В- и Т-клетках. Люди с этими синдромами не способны выработать иммунную защиту против патогенов и подвержены опасным для жизни грибковым инфекциям, пневмонии, инфекциям верхних дыхательных путей, а также пищевой и экологической аллергиям.
Виновник - измененная версия гена CARD11 - не может активировать сигнальный путь, который, в свою очередь, побуждает иммунную систему распознавать патогены и начинать защитные действия против них. Этот путь активируется большинством вакцин. В норме ген CARD11 кодирует инструкции для кластера белков, называемого олигомерами. Когда одна или обе копии гена мутируют, создавая аномальную форму олигомера, дефектная копия отменяет возможность запуска защитных реакций. В отличие от некоторых других генных мутаций, при которых одна нормальная, функциональная копия гена может обеспечить определенную защиту, некоторые мутации CARD11 серьезно влияют на олигомеры независимо от того, одна или обе копии гена мутировали.
"Белки в олигомере иногда нуждаются в том, чтобы каждая белковая субъединица в кластере была полностью функциональна, чтобы выполнять свою работу", - говорит Джоэл Померанц, доцент биологической химии в Медицинской школе Университета Джона Хопкинса. "При некоторых синдромах, связанных с CARD11, одна плохая копия гена может нарушить работу всего кластера".
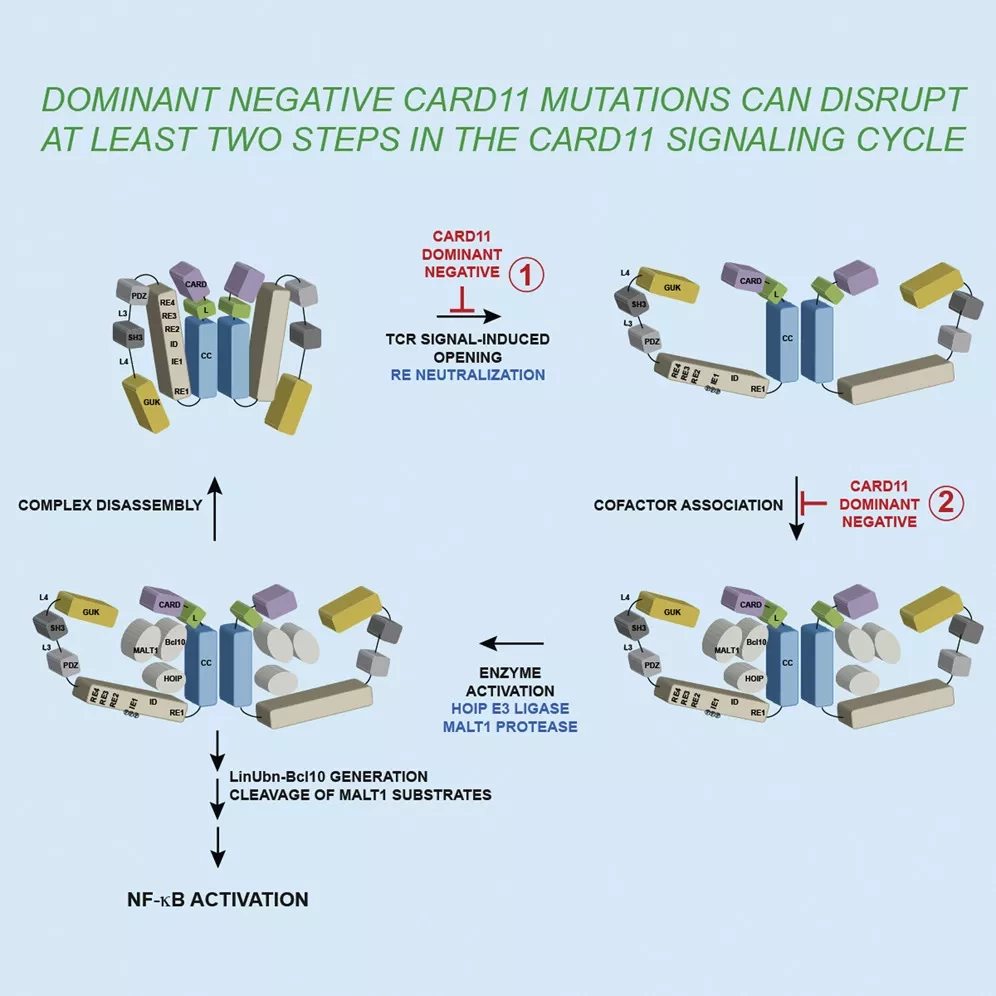
Чтобы точно определить, как это происходит, ученые сосредоточились на определении того, какой этап сигнального каскада требует, чтобы все субъединицы белка CARD11 в кластере были функциональны. Используя выращенные в лаборатории Т-клетки с функционирующими и мутировавшими генами CARD11, они отслеживали уровень белка и способность клеток активироваться и подавать сигналы другим иммунным клеткам. Они выяснили, что мутации CARD11 в первую очередь влияют на то, как белковый кластер открывается для связывания с другими белками в серии цепных реакций, которые пробуждают Т-клетки к чужеродным патогенам. В частности, они обнаружили, что мутировавшая версия CARD11 вообще не позволяет белковому кластеру открываться. Если он закрыт, кластер CARD11 не может подать сигнал другим белкам, чтобы начать иммунный ответ.
Исследователи также провели эксперименты, чтобы узнать, является ли фаза открытия единственным этапом, на который влияет мутировавший ген CARD11. Для этого они использовали генно-инженерные Т-клетки, у которых белки CARD11 постоянно находятся в открытом состоянии. Исследователи обнаружили, что даже когда белки CARD11 открыты, мутация в CARD11 блокирует сигнальный путь. "Мутация также нарушает способность субъединиц белка взаимодействовать с другими сигнализирующими партнерами и нормально функционировать", - говорит Померанц.
Состояния, возникающие в результате мутаций CARD11 в их наиболее тяжелых формах, встречаются у людей редко. Померанц надеется, что со временем ученые смогут разработать методы редактирования генов для исправления мутаций CARD11 в иммунных клетках таких пациентов. Что касается людей с генетическими вариантами менее тяжелыми, чем те, которые были изучены в данном отчете, Померанц утверждает, что полученные результаты дают представление о широкой вариативности реакций иммунной системы и могут в будущем объяснить, почему некоторые люди подвержены повышенному риску плохого исхода при контакте с болезнетворными патогенами.
"Когда мы поймем фундаментальные механизмы работы наших иммунных клеток, мы сможем лучше объяснить, как генетические вариации в генах, связанных с иммунитетом, в человеческой популяции могут привести к различным иммунологическим последствиям", - говорит Померанц.
Jacquelyn R. Bedsaul et al. Механистическое воздействие олигомерного отравления доминантно-отрицательными вариантами CARD11 (аннотация).
Скаффолд CARD11 контролирует сигнализацию антигенного рецептора к NF-κB, JNK и mTOR. Три класса герминальных мутаций в CARD11 вызывают первичный иммунодефицит, включая гомозиготные мутации с потерей функции (LOF) при дефиците CARD11, гетерозиготные мутации с усилением функции (GOF) при болезни BENTA и гетерозиготные доминантно-отрицательные LOF-мутации при CADINS.
В данном исследовании мы характеризуем LOF-мутанты CARD11 с различными доминантно-отрицательными активностями, чтобы определить механистические свойства, которые заставляют эти варианты оказывать доминантный эффект, когда они гетерозиготны. Мы обнаружили, что сильные доминантно-негативные варианты могут отравлять сигналы от смешанных олигомеров дикого типа: мутанта на двух этапах сигнального цикла CARD11, на этапе открытия и на этапе ассоциации с кофактором.
Наши результаты свидетельствуют о том, что олигомерные субъединицы CARD11 взаимодействуют по крайней мере на двух этапах сигнализации антигенного рецептора, и показывают, как различные LOF-мутации в одном и том же олигомерном сигнальном узле могут вызывать заболевания с различным характером наследования.