Раковые клетки могут стать устойчивыми к лечению в результате адаптации, что делает их очень трудными для уничтожения и смертельно опасными.
Директор Онкологического центра Лаборатории Колд Спринг Харбор (CSHL) Дэвид Тувесон и его коллеги исследовали основы "адаптивной устойчивости", характерной для рака поджелудочной железы. Они обнаружили один из резервных вариантов, на который переключаются эти клетки при столкновении с препаратами, убивающими рак. Результаты исследования опубликованы в Proceedings of the National Academy of Sciences.
KRAS - это ген, который управляет делением клеток. Большинство раковых опухолей поджелудочной железы имеют мутацию в белке KRAS, вызывающую неконтролируемый рост. Но препараты, блокирующие мутант KRAS, не останавливают пролиферацию. Раковые клетки находят способ обойти блокировку и продолжают делиться. Дерек Ченг, ведущий автор исследования, сравнивает этот процесс с резервными двигателями на корабле. Он говорит:
"Если у вас отключают основной двигатель, вы как бы переходите на резервные двигатели. И на них можно выжить, корабль еще не тонет. Он все еще движется с меньшей скоростью. В конечном итоге мы хотим потопить корабль".
Тувесон и его сотрудники хотели найти эти "запасные двигатели" в этих раковых клетках. Они использовали метод, называемый биотиновой бесконтактной маркировкой, чтобы определить, какие еще белки взаимодействуют с мутантным KRAS. Ченг говорит: "По сути, я прикрепляю аэрозольный баллончик к своему любимому белку, или, в данном случае, к наименее любимому белку. Он прикрепляет биотин, распыляя биотиновую "краску" на близлежащие белки, и мы можем проанализировать какие белки были помечены".
Ученые обнаружили "биотиновую краску" на белке RSK1, который является частью комплекса, поддерживающего в спящем состоянии соседнюю группу белков, называемых белками RAS. Исследователи с удивлением обнаружили, что когда они инактивировали мутант KRAS, близлежащий комплекс RSK1 также перестал работать. Это позволило белкам RAS активизироваться и взять на себя работу отсутствующего мутанта KRAS.
Для остановки развития клеток рака поджелудочной железы могут потребоваться препараты, способные одновременно воздействовать на несколько молекул. Тувесон надеется раскрыть большее количество игроков, способствующих адаптации раковых клеток, чтобы усовершенствовать будущие методы лечения.
Derek K. Cheng et al. Онкогенный KRAS задействует путь RSK1/NF1 для подавления сигнализации RAS дикого типа при раке поджелудочной железы (аннотация).
Протоковая аденокарцинома поджелудочной железы (PDAC) является смертельно опасной злокачественной опухолью с ограниченными возможностями лечения. Хотя активирующие мутации ГТФазы KRAS являются преобладающей зависимостью, присутствующей у >90% пациентов с PDAC, непосредственное воздействие на мутанты KRAS в PDAC было затруднено. Аналогичным образом, стратегии, направленные на известные нижележащие эффекторы KRAS, имели ограниченный клинический успех из-за механизмов обратной связи, альтернативных путей и токсичности, ограничивающей дозу в нормальных тканях.
Поэтому выявление дополнительных функционально значимых взаимодействий KRAS при PDAC может позволить лучше понять механизмы обратной связи и открыть потенциальные терапевтические мишени. В данном исследовании мы использовали бесконтактное мечение для выявления белковых интеракторов активного KRAS в клетках PDAC. Мы экспрессировали слияния дикого типа (WT) (BirA-KRAS4B), мутантного (BirA-KRAS4BG12D) и нетрансформирующегося цитозольного двойного мутанта (BirA-KRAS4BG12D/C185S) KRAS с биотин-лигазой BirA в мышиных клетках PDAC. Масс-спектрометрический анализ показал, что RSK1 избирательно взаимодействует с мембраносвязанным KRASG12D, и мы продемонстрировали, что для этого взаимодействия необходимы NF1 и SPRED2.
Мы обнаружили, что мембранный RSK1 опосредует отрицательную обратную связь с сигналом WT RAS и препятствует пролиферации клеток рака поджелудочной железы при абляции мутантного KRAS. Наши результаты связывают NF1 с мембранно-локализованными функциями RSK1 и подчеркивают роль сигнализации WT RAS в развитии адаптивной устойчивости к ингибиторам, специфичным для мутантного KRAS, при PDAC.
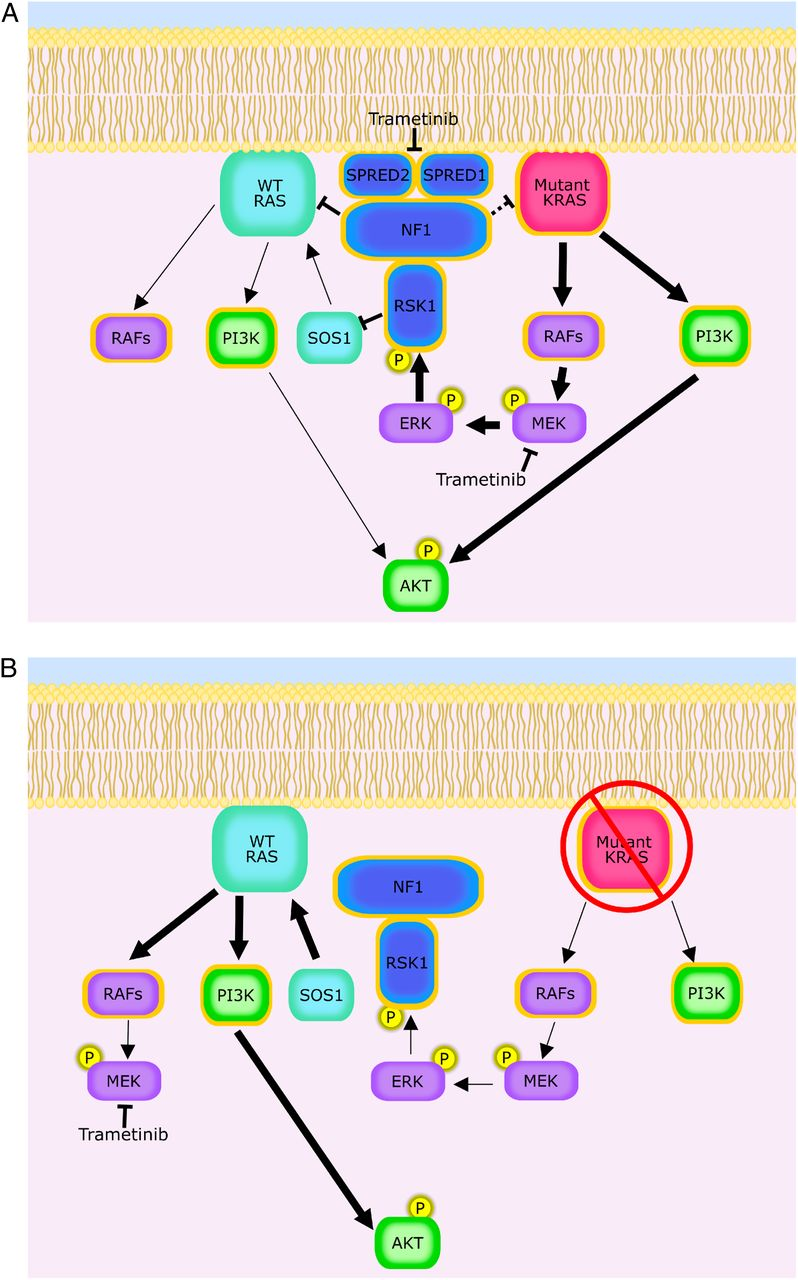
Онкогенный KRAS вовлекает RSK1/NF1 путь для ингибирования WT RAS в клетках рака поджелудочной железы. Схемы, иллюстрирующие взаимодействия RSK1/NF1 и известные механизмы опосредованной RSK1 отрицательной обратной связи на пути RAS.