Обычный препарат-ингибитор опухолей может вызывает благоприятные и неблагоприятные иммунные эффекты.
Иммунотерапия рака с использованием препаратов, подавляющих CTLA-4, также активирует нежелательный ответ, который может самоограничить ее эффективность в борьбе с опухолями, говорится в новом исследовании под руководством Франческо Марангони, доцента кафедры физиологии и биофизики и сотрудника Института иммунологии Калифорнийского университета в Ирвайне. Результаты исследования опубликованы онлайн в Cell.
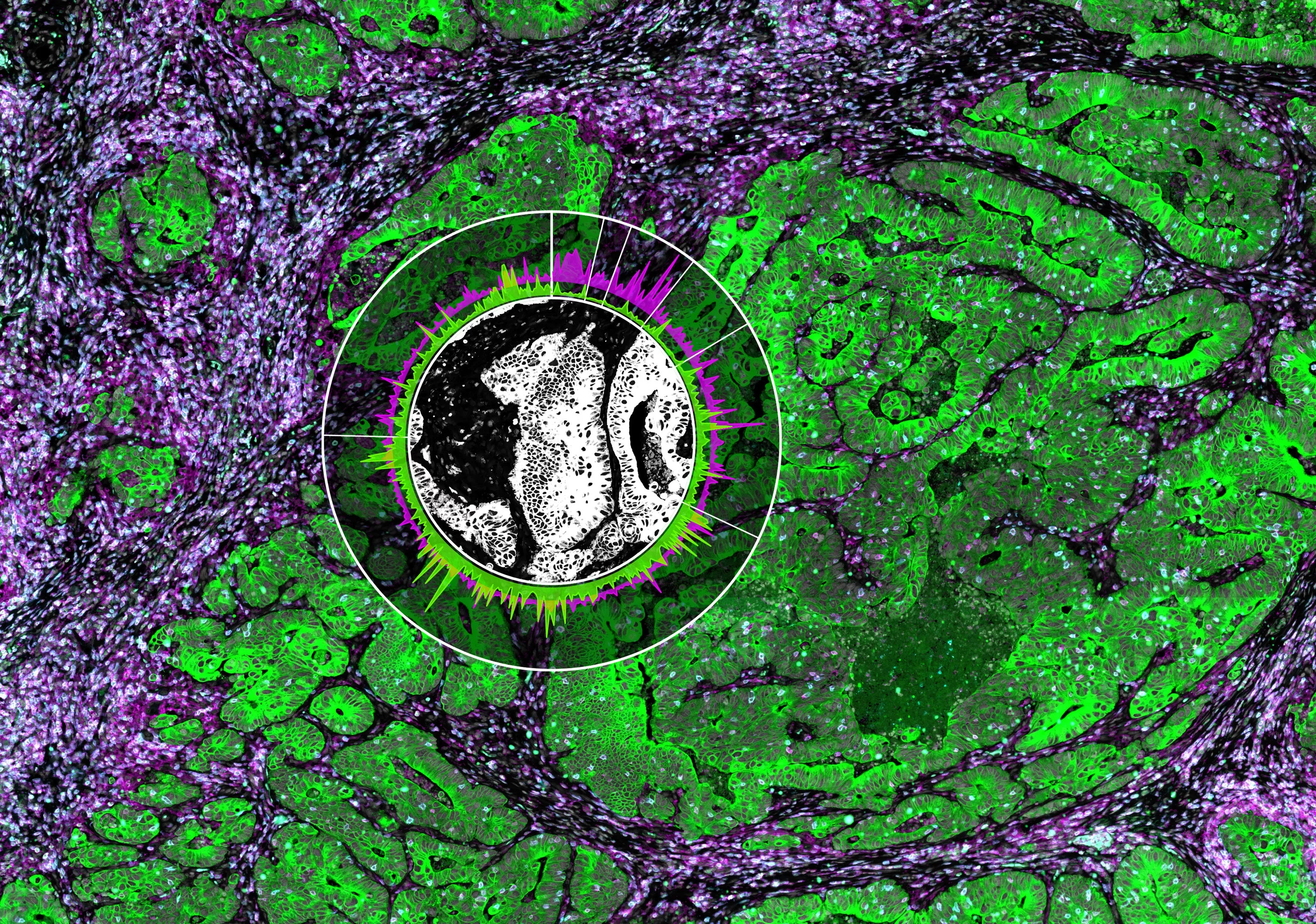
Использование собственной иммунной системы человека - иммунотерапия - для лечения рака может также стимулировать регуляторные Т-клетки, которые необходимы для предотвращения аутоиммунитета, но при этом ограничивают контроль над опухолью. Некоторые противораковые препараты семейства ингибиторов контрольных точек блокируют молекулу CTLA-4 и активируют эффекторные Т-клетки CD8 и CD4, которые уничтожают рак. Используя интравитальную микроскопию - метод, позволяющий визуализировать клетки внутри живого организма, - исследователи обнаружили, что блокирование CTLA-4 также вызывает увеличение количества регуляторных Т-клеток, что снижает эффект иммунотерапии.
"Большая часть наших знаний о механизмах, с помощью которых работает иммунотерапия, сосредоточена на положительных аспектах реакции организма, но это лечение направлено на всю иммунную систему. В этом исследовании мы изучили, как Treg-клетки активируются в опухолевой массе. Мы обнаружили, что Treg-клетки постоянно активируются в раковой опухоли. В свою очередь, они используют CTLA-4 для обучения дендритных клеток тому, чтобы они стали неэффективными активаторами иммунной системы.
При ингибировании CTLA-4 дендритные клетки становятся более активными и способствуют одновременному функционированию эффекторных и регуляторных Т-клеток. Это может ограничить эффективность и объяснить неудачу иммунотерапии у некоторых пациентов", - рассказал Марангони, автор-корреспондент исследования.
Будущие исследования будут направлены на выявление и устранение нежелательных иммунных реакций в других формах иммунотерапии. В частности, необходимо разработать новые стратегии для контролируемого снижения активации Treg-клеток, чтобы избежать "фатального аутоиммунитета", - сказал Марангони: "Беспорядочное истощение Treg-клеток заставит эффекторные T-клетки CD8 и CD4 атаковать наше тело и потенциально убить нас".
Francesco Marangoni et al. Экспансия опухоль-ассоциированных Treg-клеток при нарушении CTLA-4-зависимой петли обратной связи (аннотация).
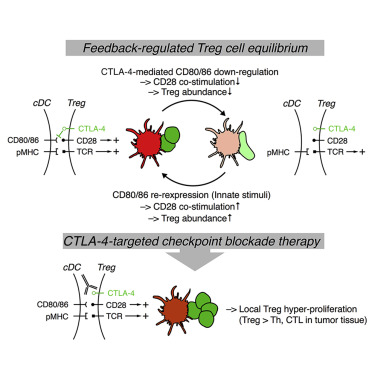
Foxp3+ T-регуляторные (Treg) клетки способствуют иммунологической толерантности опухоли, но как их иммуносупрессивная функция регулируется в микроокружении опухоли (TME), остается неизвестным. В данном исследовании мы использовали интравитальную микроскопию для характеристики клеточных взаимодействий, которые обеспечивают инфильтрирующие опухоль Treg-клетки критическими сигналами активации. Мы обнаружили, что репертуар поликлональных Treg-клеток предварительно обогащен для распознавания антигенов, представленных ассоциированными с опухолью обычными дендритными клетками (cDCs).
Нестабильные контакты cDC были достаточны для поддержания функции Treg-клеток, в то время как T-хелперные клетки активировались во время стабильных взаимодействий. Нестабильность контактов обусловлена CTLA-4-зависимым снижением регуляции ко-стимулирующих белков B7-семейства на сCDC, опосредованным самими Treg-клетками. CTLA-4-блокада вызвала CD28-зависимую гиперпролиферацию Treg-клеток в TME, а для достижения отторжения опухоли требовалась сопутствующая инактивация Treg-клеток.
Таким образом, Treg-клетки саморегулируются через CTLA-4- и CD28-зависимую петлю обратной связи, которая регулирует размер их популяции в зависимости от количества местной ко-стимуляции. Его нарушение посредством CTLA-4-блокады может нивелировать терапевтические преимущества у онкологических больных.