Исследование, проведенное учеными Калифорнийского университета, дает новое представление о молекулярной "перекрестной связи" в клетках рака поджелудочной железы, выявляя уязвимые места, которые могут стать мишенью для терапевтических препаратов, уже изучаемых при нескольких видах рака.
"Дуктальная аденокарцинома поджелудочной железы (PDAC), которая очень устойчива к существующим методам лечения, как ожидается, станет второй по распространенности причиной смертности от рака в США в течение этого десятилетия", - сказал старший автор исследования Кайус Раду, исследователь из Jonsson Comprehensive Cancer Center at UCLA и профессор кафедры молекулярной и медицинской фармакологии UCLA. "Результаты этого исследования расширяют наше понимание воспалительного микроокружения этих опухолей и предлагают целевые фармакологические стратегии, которые могут быть использованы для воздействия на эту отличительную особенность рака поджелудочной железы с помощью существующих методов лечения."
Доклиническое исследование с использованием опухолевых клеток пациентов и ксенотрансплантатов опухолей, полученных с помощью клеточных линий, опубликовано в журнале Cell Reports. В центре исследования - интерферон I типа, управляемый STING, сигнальной молекулой иммунной системы, которая препятствует распространению раковых клеток в лабораторных исследованиях, но, как правило, имеет противоположный эффект в клинической практике, где опухолевые клетки адаптируются к ним и часто становятся резистентными к лечению радиацией, химиотерапией и блокадой иммунных контрольных точек. Интерфероны вырабатываются в иммунных и других клетках, включая некоторые типы раковых клеток.
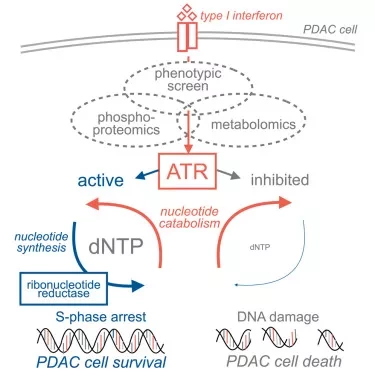
"Мы определили, что часть опухолей PDAC демонстрирует внутреннюю реакцию на интерферон, которая не моделируется стандартными условиями клеточной культуры. Используя несколько передовых методов, мы обнаружили, что интерфероновый сигнал заставляет опухолевые клетки зависеть от определенного сигнального пути для выживания. Однако если мы ингибируем белок под названием ATR, который играет важную роль в этом сигнальном пути, мы можем вызвать катастрофическое повреждение ДНК раковых клеток и запрограммированную клеточную смерть", - рассказывает Раду.
Результаты показывают, что новые препараты из молекул, которые ингибируют ATR и изучаются для лечения нескольких видов рака, включая PDAC, могут быть использованы в сочетании с "усилением" интерферона, чтобы помешать способности опухолевых клеток к бегству.
Исследователи выявили ряд молекулярных взаимодействий, приводящих к каскаду внутриклеточных событий. Посредством влияния на несколько генов интерферон изменяет метаболические процессы, поддерживающие основу ДНК раковых клеток, уменьшая поступление биохимических строительных блоков, необходимых для выживания ДНК. Чтобы компенсировать это, раковые клетки полагаются на сигнальный путь - сигнальный путь ответа на стресс репликации - который позволяет ДНК выжить, в основном благодаря влиянию ATR.
Раду отметил, что одним из потенциальных вмешательств, заслуживающих дальнейшего изучения, согласно результатам исследования, является терапия, активирующая другой сигнальный путь, называемый STING. "Активация STING индуцирует сигнализацию интерферона в клетках PDAC и запускает активацию ATR", - сказал он.
"Эта стратегия позволит усилить атаку, вызванную сигналом интерферона, и одновременно предотвратить бегство по коллатеральному пути, отключив его с помощью препаратов, ингибирующих ATR".
Evan R. Abt et al. Репрограммирование метаболизма нуклеотидов под действием интерферона обусловливает зависимость от пути ответа на стресс репликации в клетках рака поджелудочной железы (аннотация).
Мы установили, что биомаркеры ответа на интерферон I типа (IFN) обогащены в подгруппе опухолей дуктальной аденокарциномы поджелудочной железы (PDAC); однако, уязвимые места, связанные с сигналом IFN, не были систематически определены. Интеграция фосфопротеомического анализа и синергетического скрининга химической геномики показала, что IFN активирует киназу ответа на стресс репликации ataxia telangiectasia и Rad3-related белка (ATR) в клетках PDAC и делает их чувствительными к ингибиторам ATR. IFN вызывает остановку клеточного цикла в S-фазе, что сопровождается недостаточностью пула нуклеотидов и утечкой нуклеозидов. В сочетании с IFN ингибиторы ATR вызывают летальное повреждение ДНК и снижают биосинтез нуклеотидов. Ингибирование ATR ограничивает рост опухолей PDAC, в которых сигналы IFN управляются стимулятором генов интерферона (STING).
Эти результаты выявляют перекрестные связи между IFN, сетями стрессового ответа на репликацию ДНК и метаболизмом нуклеотидов, а также дают обоснование для целевых терапевтических вмешательств, направленных на усиление сигнала IFN в опухолях.