Наша собственная иммунная система может стать врагом, когда механизмы, которые на самом деле являются защитными, выходят из-под контроля.
При ANCA-ассоциированном васкулите чрезмерные воспалительные реакции приводят к легочным кровотечениям, которые могут привести к летальному исходу, если их не лечить. Исследователи Боннского университета совместно с коллегами из Германии, Нидерландов, Швейцарии и Англии расшифровали у мышей и пациентов механизм, который приводит к развитию тяжелой формы этого заболевания. Результаты исследования опубликованы в журнале Journal of Experimental Medicine.
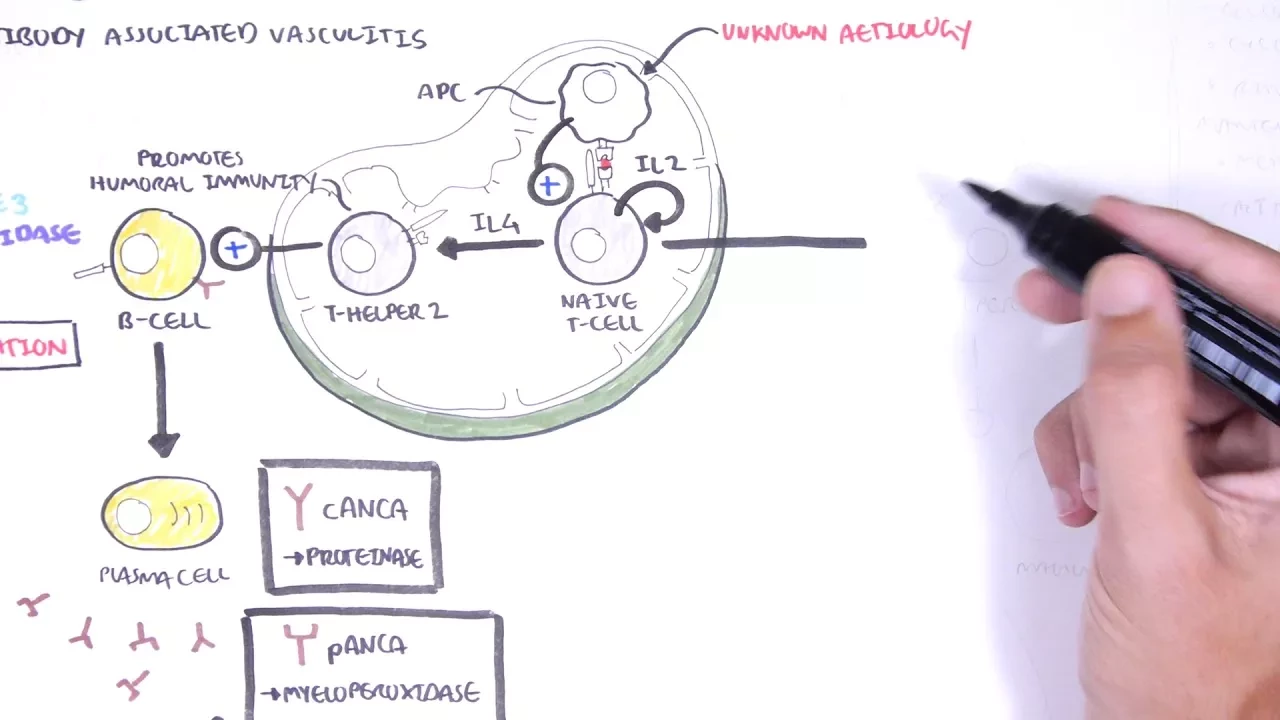
При ANCA-ассоциированном васкулите происходит сильное воспаление мелких и средних кровеносных сосудов в легких. Кроме того, могут быть поражены кожа и почки. ANCA означает "антинейтрофильные цитоплазматические антитела" - это антитела, вырабатываемые организмом против собственных лейкоцитов. Это редкое, тяжелое аутоиммунное заболевание, которое при отсутствии лечения часто приводит к летальному исходу из-за легочного кровотечения.
Терапия включает в себя прием препаратов, подавляющих иммунную систему. В последнее время также предпринимаются попытки блокировать воспалительный каскад с помощью ингибиторов. "Сложность поиска новых методов лечения заключается в том, что очень мало известно о механизмах, запускающих болезнь", - говорит руководитель исследования профессор Наталио Гарби из Боннской университетской клиники.
Ученые обнаружили механизм, ответственный за развитие заболевания в виде сигнального пути cGAS/STING/IFN-I. "Мы смогли показать в экспериментах на мышах, что симптомы этого аутоиммунного заболевания - такие как легочное кровотечение - улучшаются, когда этот сигнальный путь блокируется с помощью лекарственных препаратов", - рассказывает Гарби. В исследовании приняли участие 31 пациент с ANCA-васкулитом и, в качестве контроля, 57 здоровых людей.
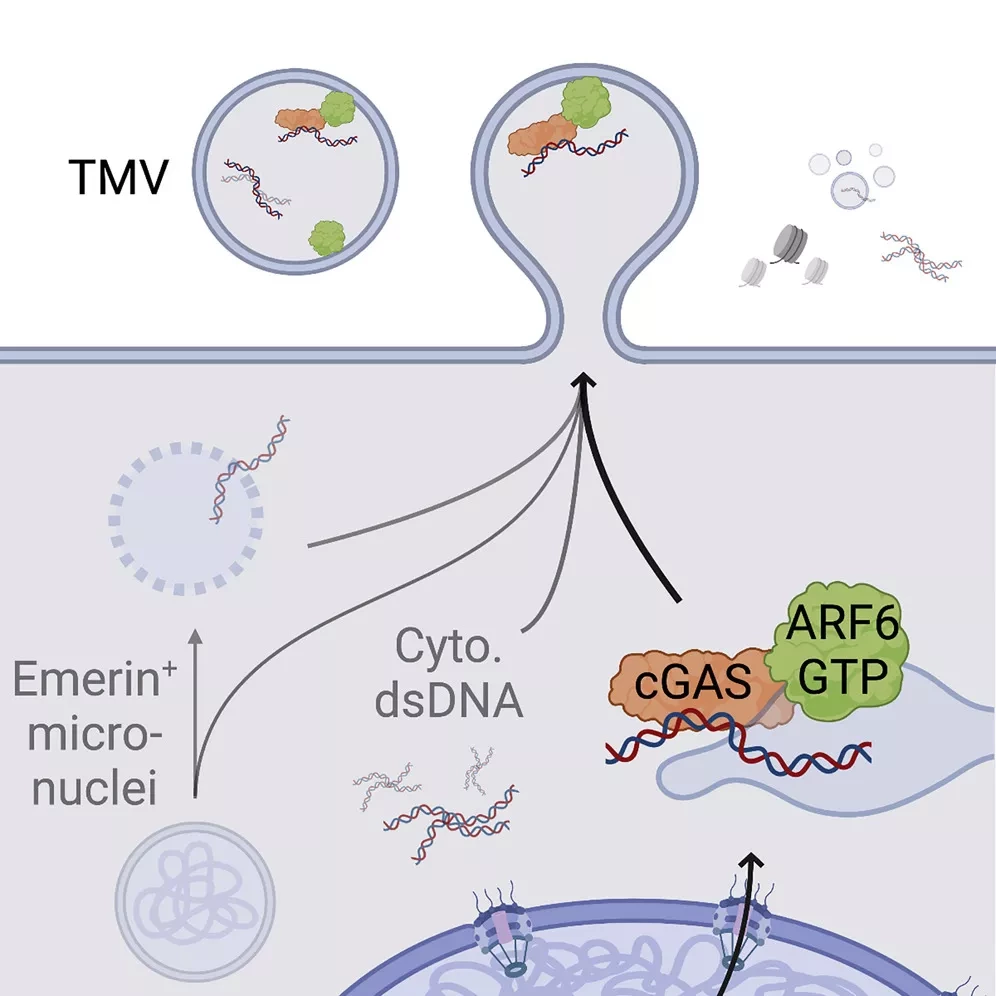
В норме генетический материал ДНК находится в ядре или митохондриях клеток. Но если патогены, такие как бактерии или вирусы, поселяются в клетке, они могут оставить после себя след ДНК в цитозоле, который обнаруживается специальным сенсором под названием cGAS. Этот датчик вырабатывает молекулу cGAMP, которая в свою очередь активирует молекулу STING. В результате происходит выработка интерферона 1-го типа (IFN-I), что приводит к сильному воспалению. Это должно предотвратить размножение патогенов и даже привести сильно инфицированные клетки к самоликвидации.
"Это становится проблематичным, когда эти механизмы запускаются не патогенами, а нашей собственной клеточной ДНК", - объясняет Гарби. Тогда сигнальный путь cGAS/STING/IFN-I приводит к гибели клеток. В нашем исследовании мы показываем, что по неизвестным пока причинам ДНК высвобождается из клеточного ядра и активирует сигнальный путь. Это приводит к разрушению кровеносных сосудов и кровоизлиянию", - объясняет Гарби.
Исследователи воссоздали наиболее важные этапы развития болезни на мышах. Для этого они ввели животным патогенные аутоантитела и ввели в их легкие бактериальные продукты, чтобы имитировать инфекцию, как это происходит во время обострения ANCA-васкулита. Затем у мышей развилось заболевание легких и кровоизлияние. В различных точках исследователи прерывали сигнальную цепь cGAS/STING/IFN-I, "глуша" определенные гены - например, для IFN-I или для определенных макрофагов иммунной системы.
На основании результатов, полученных на мышах, исследователи пришли к выводу, что именно чрезмерная активация cGAS/STING из-за неправильного расположения ДНК в клетке приводит к тяжелому заболеванию. Повышенные уровни IFN-I и cGAMP в крови пациентов, участвовавших в исследовании, позволяют предположить, что за развитие заболевания отвечает вышедший из-под контроля опекун ДНК в клетках. "Иммунные клетки являются одновременно друзьями и врагами болезни", - говорит Гарби. Макрофаги, происходящие из крови, вырабатывают воспалительную молекулу IFN-I, которая способствует развитию заболевания. В то же время другой тип макрофагов в альвеолах поглощает эритроциты, которые вытекают из сосудов, тем самым уменьшая количество провоспалительных факторов.
"Лучше понимая молекулярные процессы тяжелого ANCA-васкулита, мы смогли определить в доклинической модели потенциальные лекарственные мишени, которые уже одобрены для лечения других заболеваний", - заключает Гарби. Однако, добавляет он, все еще необходимы более интенсивные исследования.
Nina Kessler et al. Моноцитарные макрофаги усугубляют легочный васкулит через cGAS/STING/IFN-опосредованное зондирование нуклеиновыми кислотами (аннотация).
Аутоиммунный васкулит - это группа угрожающих жизни заболеваний, патогенетические механизмы которых изучены не до конца, что препятствует разработке целевых методов лечения.
В данном исследовании мы показали, что у пациентов, страдающих антинейтрофильными цитоплазматическими антителами (ANCA) - ассоциированным васкулитом (AAV), наблюдается повышенный уровень cGAMP и усиленная сигнатура IFN-I. Чтобы определить механизмы заболевания и потенциальные терапевтические мишени, мы разработали мышиную модель легочного AAV, которая имитирует тяжелое заболевание у пациентов. Иммуногенная ДНК накапливалась в начале заболевания, вызывая cGAS/STING/IRF3-зависимый выброс IFN-I, который способствовал повреждению эндотелия, легочным кровотечениям и дисфункции легких. Субпопуляции макрофагов играли дихотомическую роль в развитии болезни. В то время как рекрутированные макрофаги, происходящие из моноцитов, были основными факторами болезни, вырабатывая наибольшее количество IFN-β, резидентные альвеолярные макрофаги способствовали гомеостазу ткани, очищая эритроциты и ограничивая инфильтрацию макрофагов, вырабатывающих IFN-β. Более того, фармакологическое ингибирование STING, IFNAR-I или их последующей JAK/STAT сигнализации уменьшало тяжесть заболевания и ускоряло выздоровление.
Наше исследование раскрывает важность оси STING/IFN-I в развитии легочного AAV и определяет клеточные и молекулярные мишени для улучшения исходов заболевания.