Благодаря обширному анализу одиночных клеток исследователи из Онкологического центра Техасского университета создали пространственную карту инфильтрирующих опухоль В-клеток и плазматических клеток при раке легких на ранних стадиях, выявив ранее не оцененную роль этих иммунных клеток в развитии опухоли и результатах лечения.
Исследование, опубликованное недавно в журнале Cancer Discovery, представляет собой крупнейший и наиболее полный на сегодняшний день атлас инфильтрирующих опухоль В-клеток и плазматических клеток, который может быть использован для разработки новых стратегий иммунотерапии.
"Мы знаем, что микроокружение опухоли играет важную роль в регуляции опухолевого роста и метастазирования, но у нас неполное понимание этих взаимодействий. До сих пор основное внимание уделялось Т-клеткам. Наше исследование дает столь необходимое понимание фенотипов В-клеток и плазматических клеток, которые также играют важную роль в раннем развитии рака легких", говорит соавтор работы Линхуа Ванг.
Усовершенствованные методы скрининга увеличили долю рака легких, диагностируемого на ранних стадиях. Хирургическое вмешательство позволяет излечить некоторых пациентов, однако необходимы новые подходы к терапии, поскольку у многих из них все еще наблюдаются рецидивы заболевания. Понимание ранних взаимодействий между раковыми и иммунными клетками может открыть возможности для блокирования роста рака или усиления противоопухолевого иммунного ответа.
Предыдущее исследование, проведенное под руководством Ванг и ее коллег, показало, что B клетки имеют решающее значение для ответа на иммунотерапию у пациентов с меланомой. Кроме того, исследование, проведенное под руководством Ванг ранее, показало, что В-клетки и плазматические клетки обогащены в раке легких на ранней стадии по сравнению с нормальной легочной тканью. Плазматические клетки - это терминально дифференцированные В-клетки, ответственные за выработку антител.
Чтобы лучше понять роль этих клеток в развитии рака легких на ранней стадии, исследователи провели анализ единичных клеток в 16 опухолях и 47 соответствующих нормальных тканях легких.
Исследователи провели секвенирование РНК примерно 50 000 уникальных В-клеток и плазматических клеток для анализа профилей экспрессии их генов. Они также провели секвенирование рецепторов В-клеток на более чем 70 000 клеток, чтобы понять репертуар рецепторов В-клеток - мембранно-связанных белков на поверхности клетки, которые распознают антигены. Исследование выявило 12 различных субпопуляций клеток, причем более дифференцированные состояния (В-клетки памяти и плазматические клетки) были сильно обогащены в опухолях по сравнению с прилегающей нормальной тканью.
"Такой уровень детального анализа подчеркивает динамическое взаимодействие между опухолью и окружающей ее иммунной микросредой", - отмечает Ванг. "Наши данные показывают важность факторов окружающей среды, таких как воздействие сигаретного дыма, и молекулярных особенностей опухоли в формировании ландшафта инфильтрирующих В-клеток и плазматических клеток".
Например, опухоли курильщиков имели повышенное количество плазматических клеток и сниженную клональность В-клеток по сравнению с опухолями некурящих. Кроме того, опухоли легких с мутациями EGFR имели более низкий уровень плазматических клеток и более высокий уровень менее дифференцированных В-клеток по сравнению с опухолями с KRAS или другими мутациями.
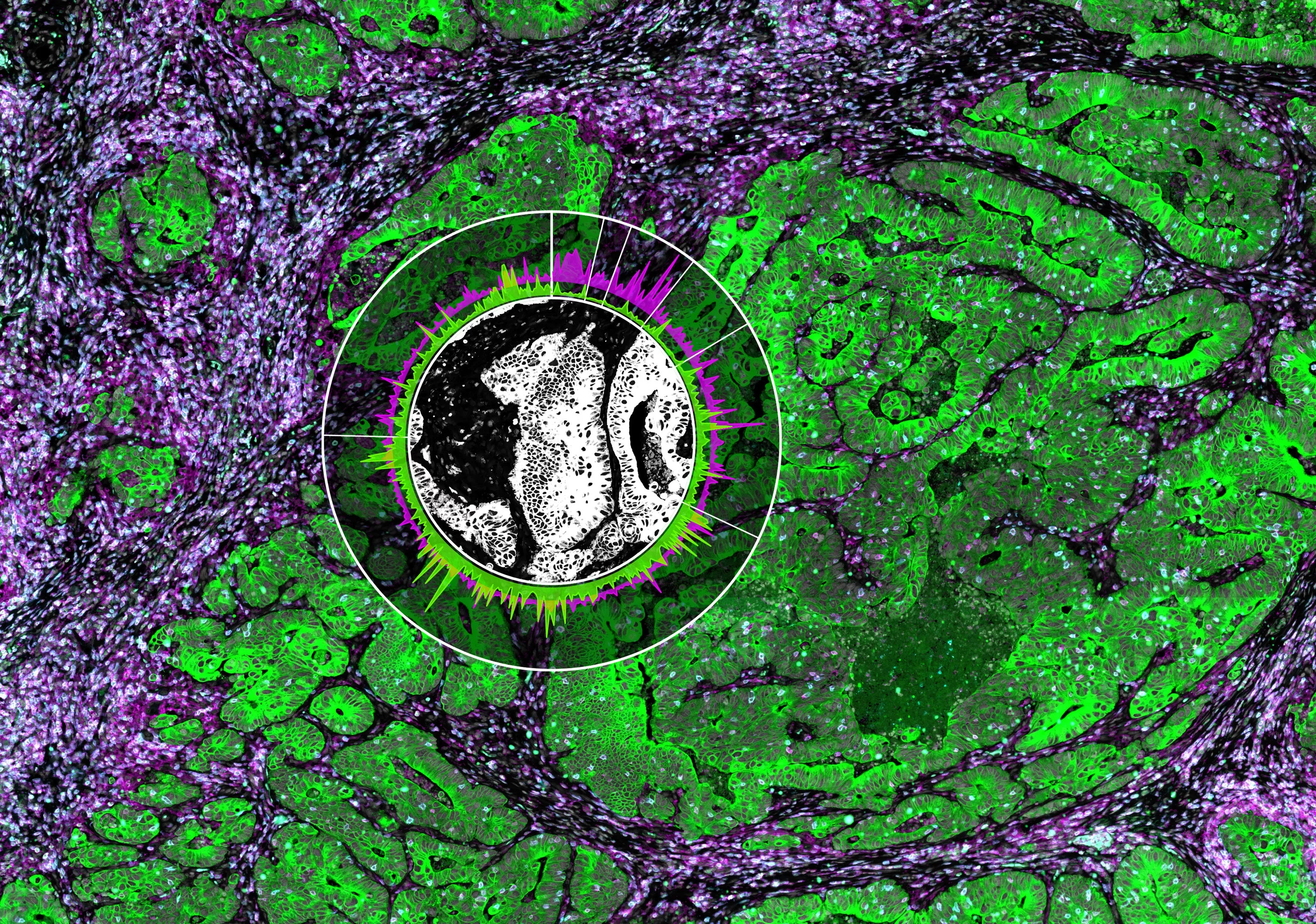
Изучая данные по отдельным клеткам вместе с пространственной информацией из опухолей, исследователи также продемонстрировали, что большинство В-клеток и плазматических клеток рекрутировались в места с высоким уровнем CXCL13. Уровень этой сигнальной молекулы повышается по мере того, как опухоли прогрессируют от предраковых поражений до инвазивного рака легких. Разнообразный ландшафт В-клеток и плазматических клеток в опухоли, по-видимому, также влияет на результаты лечения и реакцию пациентов при раке легких на ранних стадиях. В частности, обогащение опухоли плазматическими клетками наиболее сильно ассоциировалось с улучшением выживаемости и ответами на ингибиторы иммунных контрольных точек анти-PD-1/PD-L1.
"В большинстве предыдущих исследований инфильтрирующие опухоль В-клетки или плазматические клетки рассматривались как однородная популяция, но наш углубленный анализ подчеркивает гетерогенную природу этих клеток и их взаимодействие с другими компонентами микроокружения опухоли", - сказала Ванг. "Для полного понимания их роли в патогенезе опухоли необходимы дальнейшие исследования, но полученные данные свидетельствуют о том, что сигнатура плазматических клеток может быть ценным биомаркером для прогнозирования результатов иммунотерапии. Наши результаты также могут быть использованы для определения новых мишеней для иммунотерапии, направленной на инфильтрирующие опухоль В-клетки и плазматические клетки".
Будущие исследования будут опираться на фундамент, заложенный в данном исследовании, чтобы уточнить точную роль В-клеток и плазматических клеток в ранней прогрессии опухоли легких и определить наиболее перспективные терапевтические стратегии.
Hao, D., et al. Иммуногенном ландшафт одиночных клеток В и плазматических клеток при аденокарциноме легких ранней стадии (аннотация).
В аденокарциноме легкого (LUAD) преобладают опухоль-инфильтрирующие В- и плазматические клетки (TIBs), однако они плохо охарактеризованы.
Мы провели парное секвенирование РНК отдельных клеток и В-клеточного рецептора (BCR) 16 ранних стадий LUAD и 47 соответствующих мультирегиональных нормальных тканей. Путем интегративного анализа ~50 000 TIBs мы определили 12 подмножеств TIBs в LUAD и прилегающих нормальных экосистемах и продемонстрировали обширное ремоделирование TIBs в LUADs. В опухолевых тканях с более дифференцированным состоянием и повышенной частотой соматической гипермутации были высоко обогащены В-клетки памяти и плазматические клетки (PCs). У курильщиков наблюдалось значительное увеличение количества PC и различные траектории дифференцировки. Разнообразие клонотипов BCR увеличилось, но клонированность уменьшилась в LUADs, у курильщиков и с увеличением патологической стадии. TIBs были в основном локализованы в CXCL13+ лимфоидных агрегатах, а источники иммунных клеток, продуцирующих CXCL13, развивались по мере прогрессирования LUAD и включали повышенную долю CD4 регуляторных Т-клеток.
Данное исследование позволяет представить пространственный ландшафт TIBs на ранних стадиях LUAD.