Исследователи достигли фундаментального прогресса в понимании того, как Т-клетки активируются при встрече с патогенами, такими как вирусы.
В недавнем исследовании, опубликованном в Science, было установлено, что Т-клетки должны распознавать патогены в определенной пространственной ориентации, чтобы получить сильный активирующий сигнал. Т-клетки экспрессируют на своей поверхности Т-клеточный рецептор (TCR), который распознает и связывается с фрагментами вируса (антигенами), представленными инфицированными клетками. Это распознавание может привести к активации Т-клеток и уничтожению инфицированных клеток.
"Основная проблема заключается в том, что в человеческом организме существуют миллионы различных Т-клеточных рецепторов (TCR) и огромное количество вирусов, что затрудняет понимание правил, по которым распознавание вируса Т-клеточным рецептором приводит к активации Т-клеток. Фактически, это проблема, которая остается нерешенной уже более 25 лет", - говорит соавтор исследования Николь Ла Грута.
"Наше исследование показало, что пространственная ориентация, в которой связывается рецептор Т-клетки, является основным фактором, определяющим, получит ли Т-клетка активирующий сигнал", - отмечает Ла Грута. "Это прогресс в нашем фундаментальном понимании того, как Т-клетки должны "увидеть" патогенные антигены, чтобы активироваться", - говорит она. " И это позволило прояснить критический механизм, необходимый для эффективного Т-клеточного иммунитета. Это также имеет значение для разработки иммунотерапии, направленной на усиление активации Т-клеток".
Еще один соавтор работы, Пируз Зарейе подчеркнул: "Сочетание технологий, включая микроскопию со сверхразрешением, рентгеновскую кристаллографию, биохимические анализы и использование экспериментальных моделей in vitro и in vivo из различных лабораторий позволило нам сделать эти выводы".
Pirooz Zareie et al. Каноническая стыковка Т-клеточного рецептора с пептидом-MHC является необходимой для Т-клеточной сигнализации (аннотация).
Распознавание Т-клеточным рецептором (TCR) пептидов главного комплекса гистосовместимости (pMHC) является одним из самых разнообразных взаимодействий рецептор-лиганд в биологии. Тем не менее, эти взаимодействия демонстрируют высоко консервативную, или каноническую, полярность стыковки TCR-pMHC как у мышей, так и у людей. Вопрос о том, обусловлена ли эта каноническая полярность стыковки эволюционно сохраненной, кодируемой комплементарностью между TCR и MHC или сигнальными ограничениями, налагаемыми корецепторами, является предметом продолжительных дебатов. В данном исследовании мы продемонстрировали, что хотя TCR-распознавание MHC с обратной полярностью преобладает в репертуаре наивных, специфичных к вирусным эпитопам Т-клеток и может демонстрировать относительно высокую аффинность к pMHCI, такие TCR не способны поддерживать TCR-сигнализацию в присутствии корецептора CD8 из-за неправильной локализации Lck. Эти данные подтверждают парадигму, в которой высококонсервативная полярность стыковки TCR-pMHCI определяется структурными ограничениями на TCR-сигнализацию.
Имеющиеся данные свидетельствуют о том, что каноническая полярность стыковки TCR-pMHC обусловлена эволюционным жестким подключением комплементарных мотивов, кодируемых на интерфейсе TCR и MHC. Альтернативная модель предполагает, что распознавание TCR pMHC определяется во время тимического отбора потребностью корецепторов CD4 или CD8 связывать MHC и доставлять ассоциированный с корецептором Lck к сигнальному комплексу CD3.
Ранее мы выявили реверсированные полярности TRBV17+ TCR из специфического репертуара преиммунного вируса гриппа А (IAV), которые связывали pMHCI (H-2DbNP366) с умеренной аффинностью, но не могли поддерживать надежное привлечение Т-клеток. Здесь, используя ряд канонических и реверсивных TCR, специфичных для одного и того же когнатного pMHCI, мы проверили гипотезу о том, что полярность стыковки TCR-pMHCI предшествует силе связывания в качестве ключевого фактора активации Т-клеток.
Мы предположили, что основополагающим фактором канонической полярности стыковки является колокализация сигнальных молекул, центральных для пути трансдукции сигнала TCR.
Результаты
В данном исследовании мы продемонстрировали, что реверсированные TCR преобладают в наивном вирусоспецифическом репертуаре, но слабо представлены в иммунном ответе после контакта с вирусом. Мы определили антиген-специфические TCRαβ-клонотипы, которые либо плохо набирались, либо клонированно расширялись, и обнаружили преимущественную связь между иммунной превалентностью и канонической стыковкой TCR-pMHCI. Это не зависело от аффинности pMHCI, образования связей захвата или скольжения, или кластеризации TCR, демонстрируя, что каноническая полярность стыковки необходима для активации Т-клеток. Этот вывод был подтвержден после вирусного инфицирования адаптивно перенесенных ретрогенных Т-клеток, экспрессирующих реверсированные или канонические стыковочные TCR с разной аффинностью.
Неспособность Т-клеток, экспрессирующих TCR с обратным докингом, рекрутироваться в противовирусный иммунный ответ демонстрирует, что топология стыковки TCR-pMHCI превосходит аффинность TCR-pMHCI в качестве основного фактора, определяющего эффективное рекрутирование иммунитета in vivo. Используя микроскопию с визуализацией флуоресценции (FLIM)-фёрстеровский резонансный перенос энергии (FRET), мы показали, что каноническая стыковка TCR-pMHCI необходима для колокализации CD8-Lck с CD3ζ, которая нарушается, когда TCR связывается с pMHCI с обратной полярностью. Требование канонической стыковки TCR-pMHCI может быть обойдено путем удаления корецептора CD8 или диссоциации Lck от CD8, что позволяет предположить, что секвестрация Lck корецептором CD8 играет двойную роль: потенцирует сигнализацию, возникающую в результате канонических взаимодействий TCR-pMHCI, и препятствует сигнализации TCR-pMHCI с обратной полярностью.
Заключение
Неспособность TCR с обратной полярностью участвовать в иммунном ответе происходит независимо от аффинности связывания TCR-pMHCI и является прямым следствием обратного взаимодействия TCR-pMHCI. Большинство обнаруженных на сегодняшний день комплексов TCR-pMHC, на основе которых была создана каноническая парадигма стыковки TCR-pMHCI, были получены из расширенных иммунных репертуаров.
Таким образом, мы пришли к выводу, что высококонсервативная полярность стыковки определяется преимущественно структурными ограничениями, налагаемыми на сигнализацию TCR и рекрутирование в иммунный ответ. Помимо общепризнанного усиления сигнализации в результате канонического взаимодействия TCR-pMHCI, наши результаты позволяют предположить роль ассоциации корецептор-Lck в предотвращении сигнализации в результате неканонического распознавания TCR-pMHC. Такая негативная регуляция может служить для ограничения степени функциональной перекрестной реактивности TCR и сдерживания числа сигнальнокомпетентных TCR-связывающих модальностей.
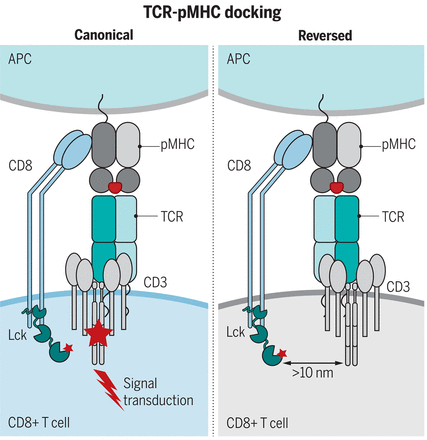
Каноническая полярность стыковки TCR-pMHC необходима для колокализации CD3 и корецептор-ассоциированного Lck и для продуктивного TCR-сигналинга.
Схема показывает, как каноническое распознавание TCR-pMHC колокализует Lck и CD3, стимулируя опосредованную TCR сигнализацию. Напротив, обратная полярность распознавания TCR-pMHC неправильно локализует Lck и CD3, препятствуя сигналу.