В новом исследовании Тель-Авивского университета впервые изучено развитие глиобластомы на животных моделях с нормальной иммунной системой, чтобы наилучшим образом имитировать развитие опухоли у человека.
Результаты исследования показали, что существуют клетки иммунной системы, которые, несмотря на то, что их основная функция - атаковать и убивать раковые клетки, на самом деле действуют как "двойные агенты", которые увеличивают и усиливают агрессивность и угрозу развития опухоли. Исследование было опубликовано в журнале Cell Reports.
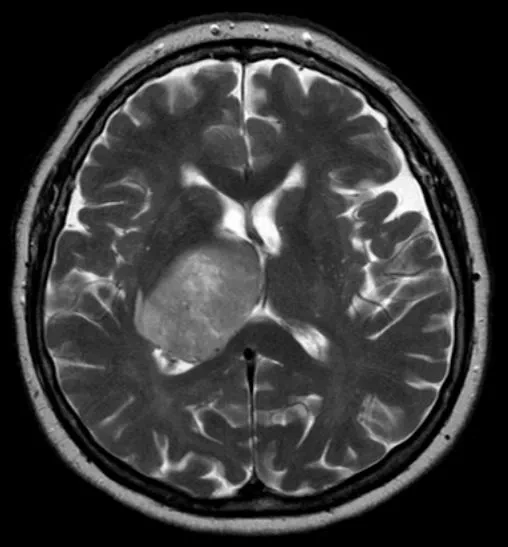
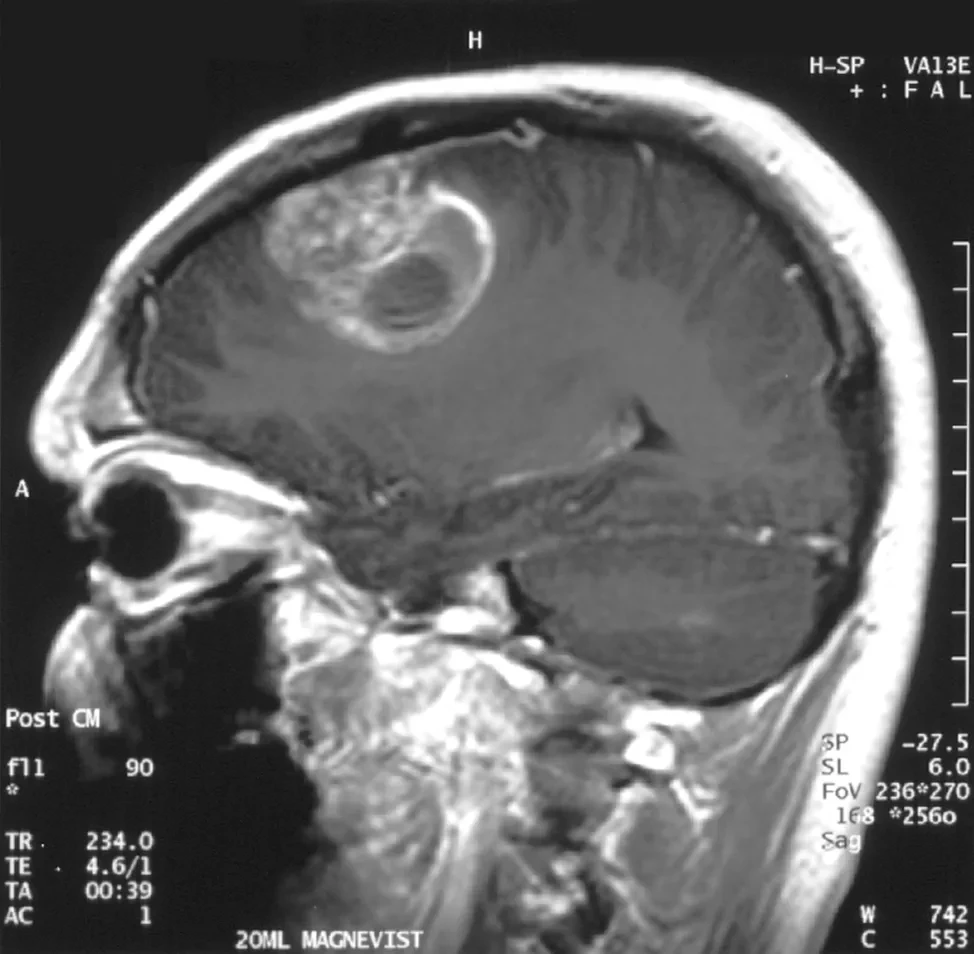
Глиобластома является наиболее распространенным видом рака мозга и одним из самых жестоких и смертоносных видов рака у людей; средняя продолжительность жизни пациентов с глиобластомой составляет от 12 до 15 месяцев с момента обнаружения. Исследователи объясняют, что обычно научное наблюдение за развитием раковой опухоли на животных моделях проводится без участия активной иммунной системы. Недостаток этой широко используемой модели заключается в невозможности отслеживать взаимодействие между иммунной системой и клетками опухоли.
В исследовании, которое проводилось в лаборатории Фридмана-Морвински, использовалась модель, изучающая развитие раковых клеток в моделях животных с функционирующей иммунной системой. Это позволило раку расти постепенно, вплоть до развития массивной опухоли, что дало возможность внимательно следить за ее развитием и в течение всего процесса за взаимодействием между раковыми клетками и различными клетками иммунной системы.
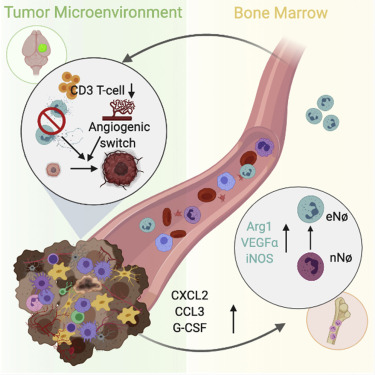
В ходе исследования ученые обнаружили, что нейтрофилы играют критическую роль во взаимодействии с раковым ростом. "Нейтрофилы - это солдаты первой линии иммунной системы", - говорит Фридманн-Морвински. "Когда начинает развиваться опухоль, нейтрофилы одними из первых мобилизуются и атакуют ее, чтобы уничтожить". Исследователи также обнаружили, что нейтрофилы остаются в непосредственной близости от опухоли на протяжении всего периода ее развития и постоянно и последовательно рекрутируются из костного мозга. Удивительно то, что нейтрофилы "меняют сторону": если на первых порах, с появлением первичной опухоли, нейтрофилы борются с ней, то со временем нейтрофилы, рекрутированные в раковую область, начинают поддерживать ее развитие.
"Мы выяснили, что нейтрофилы фактически меняют свою роль. Они мобилизуются самой опухолью и из противораковых становятся прораковыми; в результате они усугубляют повреждения, которые создает сама опухоль",
- говорит Фридманн-Морвински. Более того, исследователи обнаружили, что процесс изменения свойств нейтрофилов может происходить дистанционно, еще до того, как они продвинутся к самой опухоли.
"Исследование показало, что изменение свойств нейтрофилов происходит в самом костном мозге - там, где опухоли вообще нет: раковая опухоль находится только в мозге, и оттуда ей удается изменить свойства клеток, которые она рекрутирует", - добавляет Фридманн-Морвински. "Новые результаты этого исследования могут также послужить развитию иммунотерапевтических методов лечения, которые в последние годы набирают все большую популярность. В одном из видов иммунотерапии Т-клетки удаляются из организма пациента, перерабатываются и возвращаются в организм с повышенными исцеляющими способностями.
Одна из главных проблем сегодня заключается в том, что даже эти клетки, "отправленные на лечение", подавляются, и их действия сдерживаются. Если мы узнаем, как изменить взаимодействие между нейтрофилами и Т-клетками так, чтобы они не были супрессированы, то это повлияет на эффективность иммунотерапии". Не исключено, что эти открытия - первый шаг к расшифровке механизма взаимодействия между иммунной системой и раковыми опухолями, которые, как уже говорилось, уносят жизни множества людей.
Prerna Magod et al. Изучение лонгитюдного ландшафта микроокружения глиомы позволяет обнаружить перепрограммированные проопухолевые нейтрофилы в костном мозге (аннотация).
Недавние мультиомические исследования показывают различные композиции иммунного микроокружения опухоли (TME) при глиобластоме (GBM). Однако понимание развития TME с момента начала заболевания остается скудным. Мы используем рекомбиназу Cre (Cre)-индуцируемую лентивирусную мышиную модель GBM для сравнения клеточной эволюции иммунной TME в опухолях, инициированных различными онкогенными факторами.
Мы показали, что нейтрофилы инфильтруются на ранних стадиях развития опухоли, прежде всего в мезенхимальной модели GBM. Лишение нейтрофилов in vivo в начале заболевания ускоряет рост опухоли и сокращает среднее время общей выживаемости мышей. Мы показали, что по мере прогрессирования опухоли нейтрофилы, поступающие из костного мозга, изменяются в сторону фенотипа, связанного с проопухолевыми процессами. Наши результаты свидетельствуют о том, что GBM может дистанционно регулировать системную миелоидную дифференцировку в костном мозге для создания нейтрофилов, предварительно настроенных на опухолеподдерживающий фенотип. Эта работа показывает пластичность системного иммунного микроокружения хозяина, предлагая дополнительную точку вмешательства в лечение GBM.