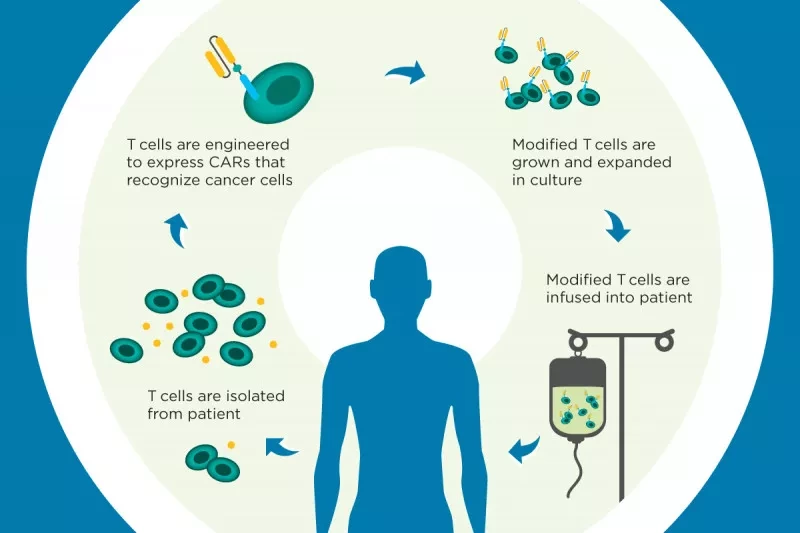
Согласно результатам проспективного исследования, у пациентов с диффузной В-крупноклеточной лимфомой, достигших стойкого ответа на лечение аксикабтагеном цилолейцелом, наблюдалось снижение уровня циркулирующей опухолевой ДНК до и после лечения.
Пациенты, у которых к 28 дню после инфузии аксикабтагена цилолейцела (Yescarta; Kite Pharma/Gilead Sciences) была достигнута негативная минимальное остаточное заболевание (MRD) - при отсутствии признаков циркулирующей опухолевой ДНК (ctDNA) - имели значительно более длительные PFS и OS, чем те, кто был MRD-положительным.
Почти у половины всех пациентов, получающих цилолейцел аксикабтаген - химерную Т-клеточную терапию, направленную на CD19 рецепторы антигена, - происходит рецидив заболевания, по словам Дэвида Б. Миклоша, клинического директора по клеточной терапии рака и профессора кафедры медицины Стэнфордского университета. Возможность определить, какие пациенты с большей вероятностью будут прогрессировать после CAR T-клеточной терапии, будет ценной для управления лечением, добавил он.
Для измерения циркулирующей опухолевой ДНК в плазме крови используется технология секвенирования следующего поколения, которая уже много лет применяется для количественной оценки MRD-статуса клеточных форм рака крови, таких как острый лимфобластный лейкоз и множественная миелома. Однако она еще не получила разрешения FDA для использования при лимфоцитарных злокачественных опухолях, включая крупноклеточную В-лимфому.
"Это коммерчески доступная диагностика, которая уже была проверена в течение более 8 лет для оценки лейкемии и теперь может быть применена для дополнения или замены ПЭТ-сканирования в следующем году", - сказал Миклош в интервью Healio.
"Наш опыт подсказывает мне, что мы должны проводить этот тест на 28-й день и проводить последующее ПЭТ-сканирование, когда ctDNA становится обнаруживаемой, чтобы определить местонахождение злокачественной опухоли".
В исследование были включены 72 пациента (средний возраст 62 года, диапазон 19-79 лет, 60% мужчин) с рецидивирующей или рефрактерной крупноклеточной В-лимфомой, которые прошли в среднем три (диапазон 1-7) предыдущих курса терапии. 60% пациентов имели три или более курсов предшествующей терапии.
Первичный анализ включал 64 пациента, 33 из которых достигли стойкого ответа на аксикабтаген цилолейцел, а у 31 из них наблюдалось прогрессирование заболевания после инфузии.
Исследователи использовали высокочувствительные анализы на основе секвенирования следующего поколения, которые выявляют специфические для лимфомы сиквенсы вариабельных, разнородных и соединяющихся генных сегментов (VDJ) клонотипов в плазме крови пациентов. Образцы собирались перед аферезом, перед лимфодеплецией и через несколько промежутков времени после инфузии, включая 28 дней, 3 месяца и 1 год. У 96 % пациентов были получены образцы ДНК, достаточные для проведения анализа.
Результаты показали, что у пациентов, достигших стойкого ответа на аксикабтаген цилолейцел, уровни прелимфодеплеции были ниже, чем у пациентов с прогрессированием заболевания (8 ЛГ/мл [диапазон, 0-1,327] против 581 ЛГ/мл [диапазон, 0-17,903]; P < .0001). У 23 (70%) пациентов, достигших стойкого ответа, ctDNA не обнаруживалась в течение 3 месяцев после инфузии, по сравнению с четырьмя (14%) пациентами, у которых наблюдалось прогрессирование заболевания (P < .0001). Выяснилось, что концентрация ctDNA до лимфодеплеции предсказывает стойкий ответ на терапию.
Исследователи сообщили, что медиана OS составила 19 месяцев для пациентов с концентрацией от 100 ЛГ/мл до 1000 ЛГ/мл, по сравнению с 7,4 месяцами для пациентов с концентрацией выше 1000 ЛГ/мл. Пациенты, у которых не была обнаружена ctDNA на 28-й день после инфузии, имели значительно лучшие показатели выживаемости, чем те, у кого была обнаружена ctDNA (медиана PFS, не достигнута против 19 месяцев; P = .0080; медиана OS, не достигнута против 3 месяцев; P < .0001). Статус MRD предсказал прогрессирование заболевания у 85% пациентов, у которых наблюдался частичный ответ или стабильное заболевание к 28 дню после инфузии. У пациентов с положительным MRD-статусом положительный прогноз рецидива заболевания составил 88%. У всех пациентов, достигших стойкого ответа на терапию при 3-месячном наблюдении, также не было обнаружено ctDNA.
Исследователи используют ctDNA "для оценки новых методов лечения и достижений в области CAR-T на основе ctDNA", - отметил Миклош.
Эти же исследовательские группы оценивают три коммерчески доступные CAR T-клеточные терапии для лечения крупноклеточной В-лимфомы, а также пациентов с мантийноклеточной лимфомой и фолликулярной лимфомой.
"В моем дальнейшем лечении пациентов наличие этого метода измерения позволит определить, за кем необходимо пристально следить на предмет прогрессирования заболевания", - сказал Миклош. "В будущем, я думаю, мы будем проводить анализ крови на наличие ctDNA до тех пор, пока не увидим прогрессирование MRD, а затем будем делать ПЭТ-сканирование, чтобы определить, где находится опухоль, в отличие от противоположного варианта, когда мы делаем ПЭТ-сканирование с низкой специфичностью, подвергая людей облучению".