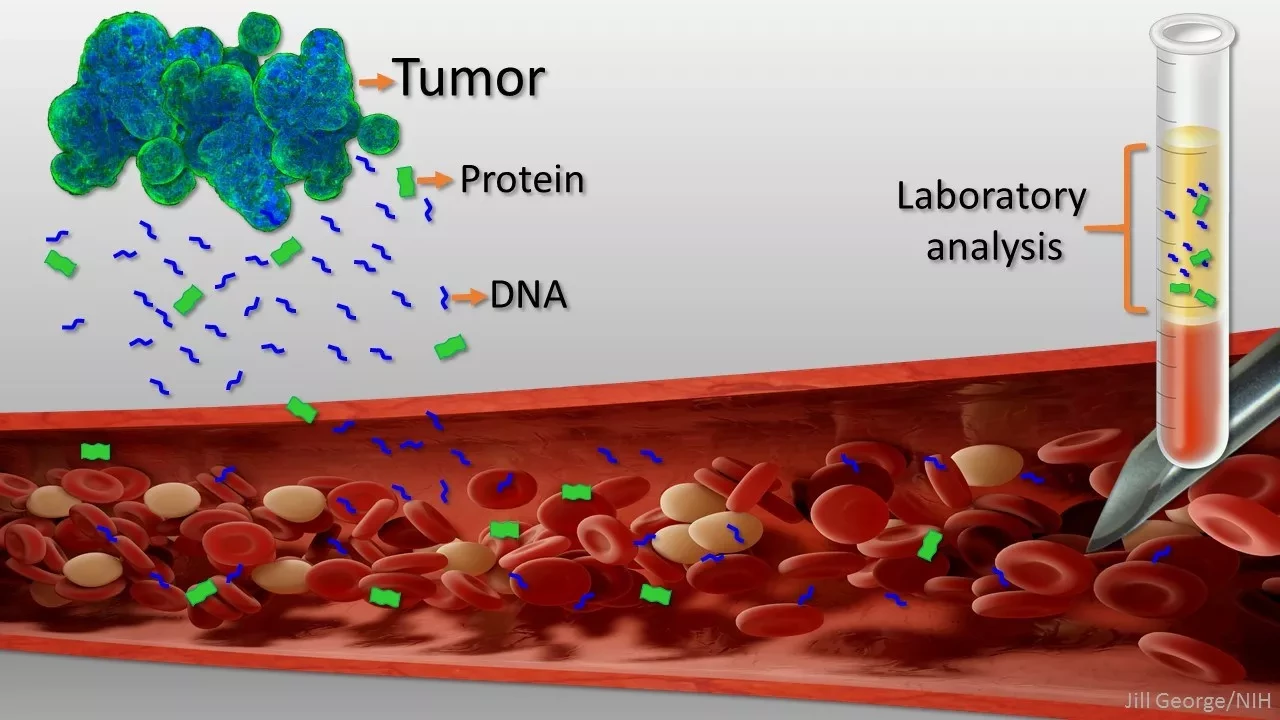
В последние годы клинические лаборатории столкнулись с многочисленными научными, технологическими и цифровыми проблемами. Данная статья призвана привлечь внимание к новой теме, которая получила широкое распространение в профессиональном сообществе, так называемой жидкостной биопсии - определению, которое на первый взгляд может показаться запутанным.
Термин "жидкая биопсия" широко используется в онкологической диагностике и был популярен в индустрии in vitro-диагностики. Эта методика применяется для определения характеристик опухоли на основе анализа циркулирующей свободной ДНК в крови. Хотя происхождение этой ДНК точно не известно, известно, что она возникает в опухолевых и неопухолевых клетках, которые не подвергаются процессам апоптоза, а также выделяют ДНК в кровоток. У онкологических больных около 50% циркулирующей ДНК соответствует мелким фрагментам опухолевой ДНК. Концентрации до 0,2 мкг/мл были документально подтверждены у больных с прогрессирующим раком, в связи с чем возникает вопрос, почему жидкая биопсия повысила и продолжает вызывать столь высокие ожидания. Традиционная биопсия является инвазивной, ткань ограничена или даже недоступна, что часто затрудняет определение гетерогенности опухоли. Однако преимущества жидкой биопсии заключаются в том, что она является малоинвазивной, менее дорогостоящей, является индикатором неоднородности опухоли, а в некоторых случаях жидкая биопсия может быть полезна для мониторинга пациента и/или эффективности к лечению. Однако, хотя это очевидно, следует учитывать, что жидкая биопсия - это не более чем другой образец крови, подлежащий обработке в клинических лабораториях.
Жидкостная биопсия в основном используется для диагностики онкологических заболеваний и проводится с использованием циркулирующей свободной ДНК из опухолевых клеток. В этой ДНК могут быть обнаружены специфические изменения, транслокации и модификации метилирования. Однако следует отметить, что жидкая биопсия используется не только в онкологических условиях. Использование жидкой биопсии в неинвазивной пренатальной диагностике также может иметь большое значение с медицинской и социальной точки зрения, свободная циркулирующая ДНК может быть обнаружена в периферической крови плода после первого триместра беременности, что делает ее очень важной пренатальной методикой диагностики. Кроме того, жидкостная биопсия не имеет ни одного из недостатков, связанных с получением проб амниотической жидкости или хорионических ворсинок.
Анализ циркулирующей свободной ДНК для диагностических целей в онкологической обстановке сложен, как показано в исследованиях характеристик клеток, вовлеченных в трансформацию опухоли. Активность онкогенов и генов-супрессоров опухолей определяет, превращается ли конкретная клетка в раковую. Дисбаланс между этими двумя факторами может привести к неконтролируемому росту клеток, ингибированию апоптоза, индукции ангиогенеза и, в конечном счете, к инвазии клеток и метастазированию. Существуют три общие категории онкогенов: рецепторы тирозинкиназы, факторы роста и транскрипционные факторы активации. С другой стороны, гены-супрессоры опухолей могут выступать в качестве регуляторов клеточного цикла или ингибиторов пролиферации.
Онкогены обнаруживаются во многих клеточных сигнальных путях, которые контролируются рецепторами тирозинкиназы. Взаимодействие этих мембранных рецепторов с факторами роста, цитокинами или гормонами активизирует соответствующий сигнальный путь. Перечень рецепторов тирозинкиназы включают рецептор эпителиального фактора роста, рецептор сосудистого фактора роста и рецептор фибробластов. Одним из наиболее широко сохранившихся сигнальных путей в клетках эукариот является путь Ras-Raf-Mek-Erk.
В присутствии специфического агониста, например, фактора роста, рецептор тирозинкиназы посылает сигнал фосфорилирования, который активизирует этот путь, вызывая каскад биологических событий, включая рост, выживание и пролиферацию или дифференцировку клеток. Многие аналитические мишени, анализируемые при жидкостной биопсии, фокусируются на изменениях в генах, участвующих в регуляции этих механизмов.
Помимо определения того, соответствуют ли обнаруженные мутации онкогену или гену-супрессору опухоли, существуют также различные ситуации в зависимости от типа изменения, которое несет мутация. Так, могут быть вариации одного нуклеотида, вставки или геномные слияния, а также вариации количества копий. Это несколько примеров, отражающих исключительную сложность молекулярной диагностики при онкологических заболеваниях. Кроме того, следует учитывать, что онкологические заболевания - это динамический процесс, и состояние опухоли может быть оценено на различных стадиях ее эволюции, например, при первых неопластических изменениях, при гетерогенности опухоли или при лечении, показывающем ответную реакцию с ремиссией или при рецидиве опухоли. Эти различные ситуации также можно рассматривать как изменения в циркулирующей свободной ДНК. Неудивительно, что огромное количество данных, полученных с помощью жидкостной биопсии, вызвало некоторое нежелание использовать эту технику в традиционных клинических лабораториях.
На данном этапе мы хотели бы указать на основные аналитические подходы и инструменты, доступные в настоящее время. Существуют, по сути, две дифференцированные аналитические стратегии. Одна из них используется для оценки четко определенных мутаций и известна как целевой анализ. Она основана на использовании мультиплексной ПЦР в режиме реального времени, которая может быть связана или не связана с последующим секвенированием и соответствующим биоинформативным анализом.
Вторая стратегия основана на секвенировании следующего поколения. Эта методика позволяет обнаружить известные и неизвестные мутации по нецелевой диагностической стратегии. В отличие от целевого анализа, этот подход не основан на использовании специальных наборов для определения мутаций. Рабочий процесс начинается с использования автоматического экстрактора ДНК с последующим внедрением ручных и автоматизированных библиотечных систем подготовки, в зависимости от количества анализируемых образцов и используемой системы анализа секвенирования. Также следует отметить системы, разработанные для специфических целей, таких как скрининг в первом триместре у беременных, который состоит из анализа циркулирующей свободной фетальной ДНК в материнской крови. Важно отметить, что в настоящее время существуют альтернативные технологии, которые могут быть адаптированы к различным диагностическим потребностям, с повышенным уровнем автоматизации, который с большой долей вероятности увеличится в ближайшем будущем.
Еще одним аспектом первостепенной важности является экономическое воздействие, которое молекулярная диагностика окажет на клинические лаборатории. Оценки показывают, что в течение ближайших 10 лет количество проводимых в США тестов на жидкую биопсию увеличится в 10 раз. Эти оценки обосновываются тем, что молекулярная диагностика позволяет использовать селективные методы лечения с продемонстрированной клинической эффективностью и, более того, в ближайшие годы резко вырастет количество обращений для мониторинга и контроля лечения.
Эти оценки последовательно свидетельствуют о том, что жидкая биопсия станет важной частью рутинной клинической лабораторной практики, учитывая неонкологическое применение циркулирующей свободной ДНК. Действительно, многочисленные исследования последних лет исследовали диагностическую полезность циркуляции свободной ДНК при различных заболеваниях. Так, она оказалась полезной в диагностике инфаркта миокарда, инсульта или в качестве биомаркера отторжения при трансплантации органов. Метод также предложен в качестве прогностического при трансплантации островков поджелудочной железы.
Наконец, некоторого внимания заслуживает преаналитическая фаза. Широко известно, что достоверность результатов зависит от тщательного преаналитического процесса, то же самое происходит и с циркулирующей свободной ДНК. В этом смысле многоцентровое европейское исследование, исследующее риск развития рака на основе концентраций ДНК, сообщило о больших межцентровых различиях по отношению к этим концентрациям. Этот вывод показывает, что, как и в случае с другими лабораторными параметрами, для получения достоверной информации из жидкостной биопсии решающее значение имеют преаналитические условия.
В заключение следует отметить, что имеющаяся в настоящее время информация и перспективы на будущее указывают на то, что внедрение процедур, связанных с жидкой биопсией/циркуляцией свободной ДНК, в клинико-диагностических лабораториях является профессиональной задачей, которая должна быть решена в самом ближайшем будущем.