Исследователи из Университета Саутгемптона получили новое беспрецедентное представление о ключевых свойствах антител, необходимых для борьбы с раком.
Междисциплинарное исследование, опубликованное в журнале Science Immunology, показало, как изменение конфигурации антител может стимулировать более сильный иммунный ответ.
Полученные результаты позволили ученым разработать антитела для активации важных рецепторов на иммунных клетках, чтобы "зажечь" их и обеспечить более мощный противораковый эффект.
Авторы считают, что их результаты могут проложить путь к совершенствованию препаратов антител, направленных против рака, а также других аутоиммунных заболеваний.
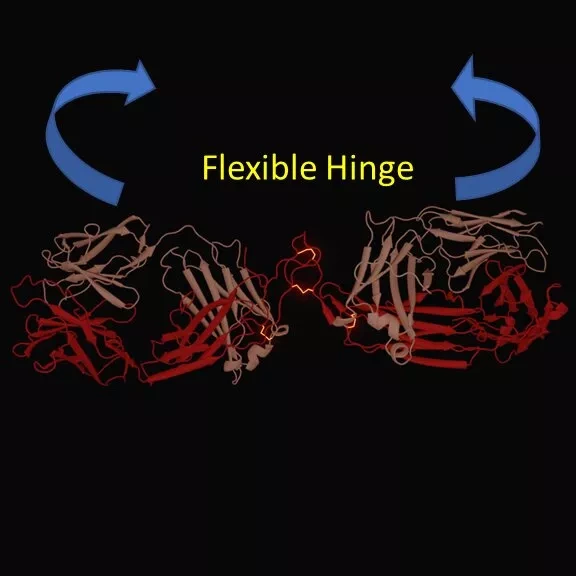
В ходе исследования группа изучала антитела, нацеленные на рецептор CD40, для лечения рака. Клиническая разработка была затруднена из-за отсутствия понимания того, как стимулировать рецепторы до нужного уровня. Проблема заключается в том, что если антитела слишком активны, они могут стать токсичными. Предыдущие исследования ученых из Саутгемптона показали, что особый тип антител под названием IgG2 уникально подходит в качестве шаблона для фармацевтического вмешательства, поскольку он более активен, чем другие типы антител. Однако причина, по которой он более активен, не была установлена. Тем не менее, было известно, что структура между рукавами антитела, так называемые "шарниры" (hinges), меняется с течением времени.
Последнее исследование использует это качество шарнира и объясняет, как оно работает: исследователи назвали этот процесс "переключением дисульфидов". В ходе исследования специалисты проанализировали эффект модификации шарнира и использовали комбинацию анализов биологической активности, структурной биологии и вычислительной химии для изучения того, как дисульфидное переключение изменяет структуру и активность антител.
Соавтор работы Иво Тьюс, доцент кафедры структурной биологии Саутгемптонского университета, рассказывает: "Наш подход заключался в том, чтобы проанализировать структуру антитела в атомных деталях, используя метод рентгеновской кристаллографии. Хотя полученная картина очень точна, информация о том, как они двигают своими "руками", отсутствует, и нам нужно было изображение антитела в растворе, для чего мы использовали метод рассеяния рентгеновских лучей, называемый SAXS. Затем мы проанализировали данные с помощью математических моделей и химико-вычислительного подхода, используя высокопроизводительный вычислительный кластер IRIDIS в Саутгемптоне". Благодаря такому детальному изучению шарнирного соединения команда обнаружила, что более компактные, жесткие антитела более активны, чем их гибкие аналоги.
Профессор Марк Крэгг, сотрудник Центра иммунологии рака при Саутгемптонском университете, отмечает: "Это исследование дало нам новую информацию о том, как создавать антитела для обеспечения лучшего иммунного ответа. Мы предполагаем, что более жесткие антитела позволяют рецепторам быть связанными ближе друг к другу на поверхности клетки, способствуя сцеплению рецепторов и усилению активности. Это означает, что, изменяя шарнир, мы можем генерировать более или менее активные антитела более предсказуемым образом. Наши результаты могут иметь более широкие последствия, поскольку они могут обеспечить высококонтролируемый и легкодоступный способ разработки антител для клинического использования в будущих иммуностимулирующих антителах".
Christian M. Orr et al. Шарнирные дисульфиды в человеческих IgG2 CD40 антителах модулируют рецепторную сигнализацию путем регулирования конформации и гибкости (аннотация).
Антитела защищают от инфекций, лежат в основе успешных вакцин и вызывают терапевтические реакции при раке и аутоиммунных заболеваниях, не поддающихся лечению. Человеческий изотип IgG2 обладает уникальной способностью подвергаться дисульфидной перестановке в шарнирной области, что приводит к модуляции его способности стимулировать сигнализацию рецепторов-мишеней (агонизм) в различных важных иммунных рецепторах посредством до сих пор необъяснимых молекулярных механизмов.
Чтобы разобраться в этом процессе и выяснить, как ориентация дисульфидных шарниров влияет на агонистическую активность, мы создали серию вариантов обмена цистеина на серин в области шарнира клинически значимого моноклонального антитела ChiLob7/4, направленного против ключевого иммунного рецептора CD40. Мы сообщаем, что агонистическая активность зависит от дисульфидного паттерна и обеспечивается наличием дисульфидного кроссовера между F(ab) плечами в агонистических формах, независимо от эпитопа, что наблюдается в определенных кристаллографических структурах. Этот структурный "переключатель" непосредственно влияет на конформацию и гибкость антител. Малоугловое рентгеновское рассеяние и модельное построение показали, что наименее гибкие варианты принимают наименьшее количество конформаций и вызывают наибольший уровень агонизма рецептора.
Это ковалентное изменение может быть использовано для широкого применения с целью модуляции рецепторной сигнализации эпитопно-независимым образом в будущих терапевтических препаратах.