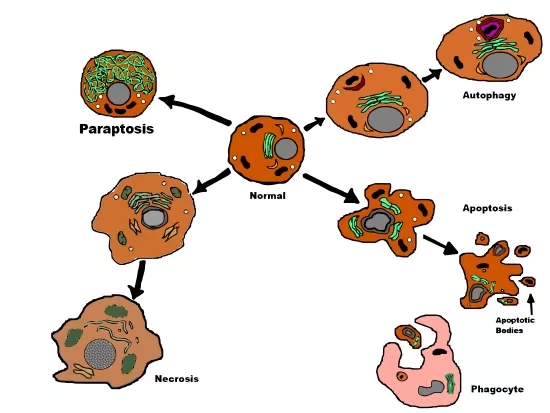
Апоптоз, разновидность запрограммированной клеточной смерти (ПКС), - это биологический процесс, посредством которого в многоклеточных организмах уничтожаются нежелательные клетки.
В большинстве клеток каспазы, запускают апоптоз. Этот процесс особенно важен для лечения рака, поскольку индуцирование клеточной смерти в раковых клетках может помочь в их уничтожении. Помимо апоптоза, в клетках происходит несколько типов ПКС, включая параптоз, некроптоз и аутофагию. Из них параптоз - самый недавно выявленный тип ПКС, который вызывается притоком избыточного кальция в клетки, что приводит к их гибели.
Раковые клетки часто становятся устойчивыми к препаратам, вызывающим апоптоз и другие типы ПКС. В таких случаях индуцирование параптоза, который не зависит от каспаз, может стать перспективной противораковой терапией. Таким образом, разработка соединений, способных индуцировать параптоз в раковых клетках, имеет решающее значение. С этой целью группа исследователей из Токийского научного университета под руководством профессора Син Аоки провела исследование по разработке новых комплексно-пептидных гибридов с потенциалом индуцирования параптоза. Это исследование опубликовано в журнале Bioconjugate Chemistry.
"Ранее мы синтезировали гибридное соединение иридиевого комплекса с пептидом и наблюдали, что оно индуцирует гибель клеток в раковых клетках, что отличалось от апоптоза. Поскольку это соединение не было похоже на другие соединения, индуцирующие параптоз, мы хотели понять механизм индукции параптоза. Теперь наша цель - синтезировать новые соединения и выяснить, как они вызывают параптоз в клетках, прежде чем мы поделимся этой важной информацией с общественностью", - объясняет профессор Аоки, рассказывая о мотивах, побудивших ученых провести это исследование.
Новые синтезированные соединения состояли из триптиценового ядра - ароматического углеводорода - с двумя или тремя катионными пептидами из аминокислот лизина и глицина через алкильную цепь C8 в разных местах триптиценовых единиц. В результате были получены три гибрида триптиценового ядра (TPH), а именно 5, syn-6 и anti-6.
Затем группа провела эксперименты на клетках Jurkat, типе иммортализованных человеческих лимфоцитов, используемых в исследованиях, с целью понять тип ПКС, который происходил в этих клетках при обработке syn-6 и anti-6. Они обнаружили, что гибель этих клеток была подавлена карбонилцианид-м-хлорфенилгидразоном, который является реагентом для разобщения и ингибитором поглощения митохондриального кальция, RuRed, являющимся ингибитором митохондриального кальциевого канала, и 2-аминоэтоксидифенилборатом (2APB), являющимся ингибитором D-инозитол-1,4,5-трисфосфатного рецептора. Однако гибель клеток не подавлялась ингибиторами других типов ПКС. Таким образом, они исключили аутофагию, некроптоз и апоптоз, подтвердив, что параптоз является основным путем ПКС, индуцированным syn-6 и anti-6 в клетках Jurkat.
"Исследования показали, что TPHs syn-6 и anti-6 вызывают перенос избыточного кальция из эндоплазматического ретикулума (ЭР) в митохондрии, что приводит к потере мембранного потенциала митохондрий. Вполне вероятно, что эти явления тесно связаны со слиянием ЭР с митохондриями, за которым следует цитоплазматическая вакуолизация, приводящая к гибели клетки", - пояснил профессор Аоки, отвечая на вопрос, почему именно эти два TPH были выбраны для исследования. TPHs syn-6 и anti-6 являются более гидрофильными, чем другие TPHs, что также может быть причиной их высокого противоракового потенциала, вызывающего параптоз.
Проведя дополнительные эксперименты по визуализации, авторы обнаружили наличие цитоплазматической вакуолизации, повышенную концентрацию митохондриального кальция и деградацию ЭР в клетках Jurkat, обработанных syn-6 и anti-6. Основываясь на предыдущих результатах, исследователи предположили, что и в клетках Jurkat приток кальция в митохондрии может быть облегчен близким расположением ЭР и митохондрий. Как и ожидалось, они обнаружили, что мембраны ЭР и митохондрий прикреплены друг к другу, что облегчает прямой перенос кальция.
Эти результаты подтвердили, что клетки Jurkat, обработанные syn-6 и anti-6, подверглись запрограммированной клеточной смерти вследствие параптоза. Они также предоставляют важную информацию для разработки соединений, которые могут быть использованы в качестве терапевтических агентов против рака и других заболеваний.
Остается надеяться, что эти многообещающие результаты будут способствовать разработке эффективной терапии против постоянно эволюционирующих раковых клеток.
Kohei Yamaguchi et al. Дизайн, синтез и противораковая активность триптицен-пептидных гибридов, вызывающих параптотическую клеточную смерть в раковых клетках (аннотация).
Мы сообщаем о разработке и синтезе триптицен-пептидных гибридов (TPHs), 5, syn-6 и anti-6, которые представляют собой конъюгаты триптиценового ядра с двумя или тремя катионными пептидами KKKGG (K: лизин и G: глицин) через алкильную цепь C8. Было обнаружено, что syn-6 и anti-6 вызывают параптоз, тип запрограммированной клеточной смерти (PCD), в клетках Jurkat (лейкемические Т-лимфоциты). Механистические исследования показывают, что эти TPH вызывают перенос Ca2+ из эндоплазматического ретикулума (ER) в митохондрии, потерю мембранного потенциала митохондрий (ΔΨm), связывание ER и митохондрий и цитоплазматическую вакуолизацию в процессе параптоза.