В новом исследовании ученые под руководством Сержа Ю. Фукса из Пенсильванского университета раскрыли подробный механизм, с помощью которого опухоли могут обходить как иммунную систему, так и методы лечения рака, использующие ее мощь, например, генно-инженерные CAR T-клетки.
Их исследование, опубликованное в журнале Cell Metabolism, показало, как опухолевые факторы стимулируют трогоцитоз - процесс, происходящий от греческого слова trogo, что означает "грызть" или "жевать". Когда Т-клетки взаимодействуют с раковыми клетками, они иногда могут "откусить" кусочек мембраны раковой клетки. Если этот участок мембраны содержит антиген, молекулу, специфичную для рака, Т-клетки могут начать экспрессировать этот антиген на своей собственной клеточной поверхности, в результате чего другие Т-клетки будут воспринимать их как раковые клетки. Трогоцитоз может поражать собственные Т-клетки пациента и Т-клетки, модифицированные в CAR T-клетки - подход, при котором Т-клетки пациента генетически модифицируются для специфической борьбы с раковыми клетками, выращиваются в лаборатории, а затем доставляются обратно пациенту.
"Трогоцитоз может привести к трем разным вещам, и все три варианта плохи для человека с опухолью", - объясняет Фукс, старший автор работы. "Во-первых, опухолевая клетка не была убита и потеряла антиген, что может означать, что даже если появится другая, лучше оснащенная Т-клетка, она не распознает ее, давая раковым клеткам возможность бесконтрольно расти. Вторая проблема заключается в том, что по непонятным пока причинам, как только Т-клетка захватывает часть мембраны опухолевой клетки, она становится гораздо менее активной. И третья проблема очень парадоксальна. Потому что теперь Т-клетка, которая отображает опухолевый антиген, эта "овца в волчьей шкуре", может стать жертвой "братоубийства", убитая другой Т-клеткой". В целом, результатом является снижение числа и активности Т-киллеров и увеличение возможностей для раковых клеток избежать обнаружения и расти.
"Мы видим, что только небольшое количество клеток подвергается трогоцитозу, а затем они быстро исчезают, потому что их убивают. Таким образом, мы изучаем исчезающее действие. Это трудно сделать - очень дорого и очень утомительно - но, похоже, это очень важно", - говорит Фукс. Фукс и его коллеги, давно интересующиеся тем, как рецепторы на поверхности иммунных клеток управляют противораковым иммунитетом, сделали целый ряд открытий, показывающих, как опухоли могут манипулировать Т-клетками, чтобы избежать их уничтожения.
Особый интерес представляет так называемые опухолевые факторы, или смесь белков, липидов и других материалов, которые раковые клетки выделяют в организм. В текущем исследовании ученые обнаружили, что если собрать эти выделения и подвергнуть полученный раствор воздействию Т-клеток, то это помешает клеткам выполнять свою работу по борьбе с раком. "Просто подвергая их воздействию этой среды, кондиционированной опухолью, они убивали меньше раковых клеток, чаще подвергались трогоцитозу и больше погибали", - говорит Фукс.
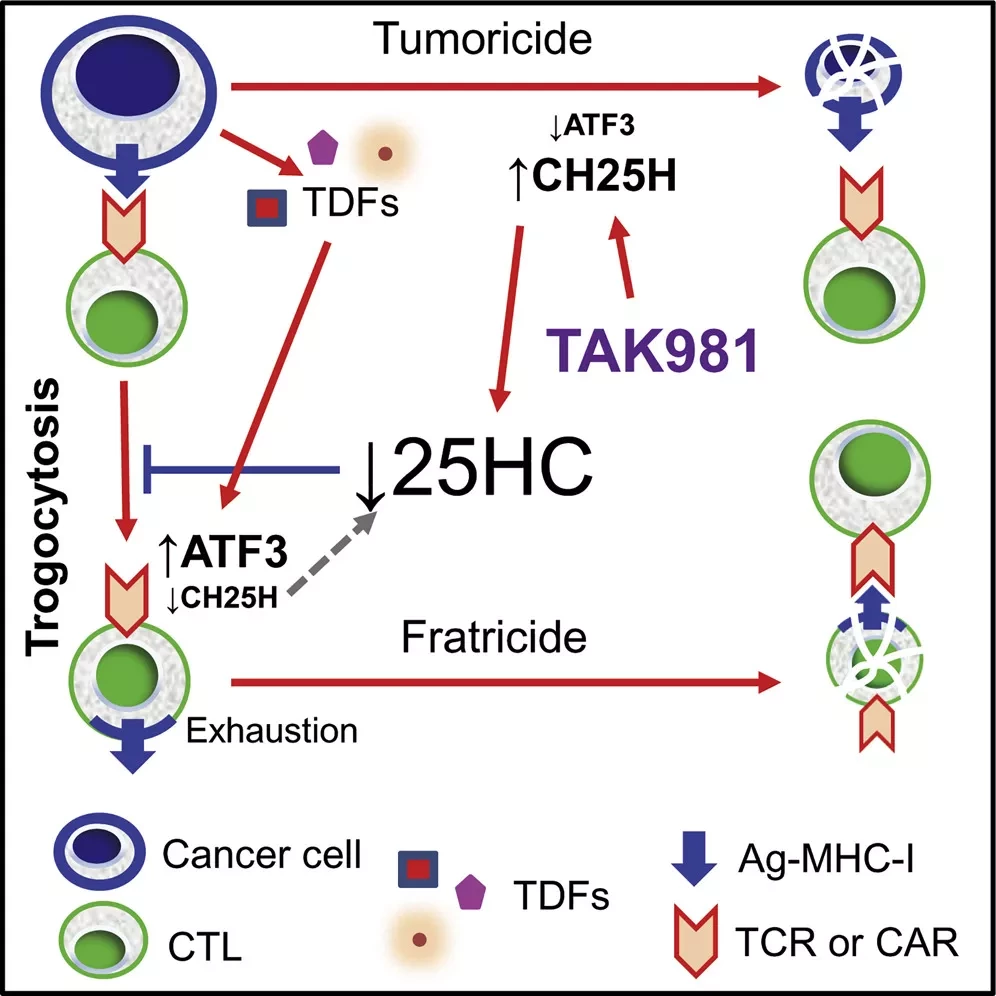
Ранее считалось, что трогоцитоз как-то связан со способностью рака препятствовать противораковому иммунитету, но исследователи из Пенсильванского университета установили его механизм, показав, что в Т-клетках, подвергшихся воздействию опухолевых факторов, наблюдается заметное снижение уровня гена CH25H. Этот ген, как известно, участвует в изменении липидных мембран клеток и может препятствовать слиянию двух клеточных мембран - необходимому процессу для трогоцитоза. Когда они добавили метаболит, вырабатываемый CH25H, они смогли заблокировать трогоцитоз. Это был момент "ага", - рассказывает Фукс. Дальнейшая характеристика механизма помогла специалистам выявить еще одного игрока - ген ATF3, который противодействует активности CH25H. Устранение AFT3 предотвратило трогоцитоз и восстановило способность Т-клеток убивать опухолевые клетки.
Новые данные не только предлагают новые мишени для противораковой терапии, но и могут иметь непосредственное значение для CAR T терапии. Поскольку трогоцитоз может снижать эффективность разработанных Т-клеток, поставляемых в CAR T, исследователи предположили, что его блокирование может повысить эффективность CAR T. Мы подумали: "Почему бы нам не использовать так называемый "бронированный CAR" подход и не экспрессировать CH25H в CAR T", - говорит Фукс. "Это оказалось более эффективным, чем старые CAR T клетки". Действительно, доставка CAR T-клеток, оснащенных CH25H, повысила выживаемость мышей с раком по сравнению с небронированными CAR T-клетками.
Хотя в трогоцитозе участвует лишь небольшой процент Т-клеток, Фукс говорит, что этот процесс может быть недооцененным, когда речь идет об иммунитете против рака и других процессах, например, связанных с аутоиммунитетом. В дальнейшей работе он и его коллеги намерены изучить роль ATF3 и CH25H и других молекул в трогоцитозе. И он надеется, что другие исследователи подхватят эти направления работы, приблизив полученные результаты к клиническому применению. "Я вижу, как это быстро используется в CAR T терапии", - говорит Фукс. " Это уже готово к применению".
Zhen Lu et al. ATF3 и CH25H регулируют эффекторный трогоцитоз и противоопухолевую активность эндогенных и иммунотерапевтических цитотоксических Т-лимфоцитов (аннотация).
Эффекторный трогоцитоз между злокачественными клетками и опухолеспецифическими цитотоксическими Т-лимфоцитами (CTLs) способствует иммунному уклонению за счет потери антигена на клетках-мишенях и уничтожения антигенно-опытных CTLs другими CTLs. Механизмы, регулирующие эти события в опухолях, остаются малоизученными.
В данном исследовании мы показали, что опухолевые факторы (TDFs) стимулируют эффекторный трогоцитоз и ограничивают опухолецидную активность и жизнеспособность CTLs in vitro. TDFs сильно изменяли липидный профиль CTL, включая истощение 25-гидроксихолестерина (25HC). 25HC ингибировал трогоцитоз и предотвращал инактивацию и уничтожение CTL. Механистически, TDFs индуцировали фактор транскрипции ATF3, который подавлял экспрессию 25HC-регулирующего гена - 25-гидроксилазы холестерина (CH25H). Стимуляция трогоцитоза во внутриопухолевых CTL с помощью оси ATF3-CH25H ослабляла противоопухолевый иммунитет, стимулировала рост опухоли и снижала эффективность адоптивной терапии химерными антигенными рецепторами (CAR) Т-клеток. Благодаря использованию "бронированных" CAR-конструкций или фармакологических агентов, восстанавливающих экспрессию CH25H, мы обратили вспять эти фенотипы и повысили эффективность иммунотерапии.