Пациенты, у которых недавно диагностировали рак, обычно сосредотачиваются на одном вопросе, затмевающем все остальные: "Каков мой прогноз?"
Определение прогноза больного раком - вероятного течения и исхода болезни - обычно включает в себя стадирование лимфатических узлов - процесс, в ходе которого изучаются такие факторы, как размер лимфатического узла, его расположение и то, насколько далеко рак распространился за пределы узла.
Однако в настоящее время стадирование лимфатических узлов сильно варьирует в зависимости от локализации рака, говорит Закари С. Зумстег, доцент кафедры лучевой онкологии в онкологическом центре Cedars-Sinai. Поскольку стадирование помогает определить, какую терапию будут получать пациенты, его правильное проведение должно быть последовательным, точным и универсальным, а это не всегда так, добавил он. Исследование под руководством Зумстега, недавно опубликованное в Journal of the National Cancer Institute, подтвердило эффективность универсального процесса стадирования лимфатических узлов, который потенциально может сделать именно это.
"Подсчитайте количество метастатических лимфатических узлов", - говорит Зумстег. "Мы обнаружили, что этот простой процесс гораздо лучше определяет прогноз при солидных опухолях, чем все остальные факторы, используемые сегодня. Он должен стать основой стадирования узлов, потому что это лучший предиктор смертности, независимо от локализации заболевания".
Для проверки своей гипотезы о том, что подсчет метастатических узлов может быть использован для создания объективных и воспроизводимых систем классификации узлов для всех солидных опухолей, исследователи провели ретроспективный анализ почти 1,3 миллиона пациентов из National Cancer Database, которым был поставлен диагноз в период с 2004 по 2015 год. Исследователи также использовали данные еще 2 миллионов пациентов из реестра Surveillance, Epidemiology and End Results.
Результаты исследования, проверенные на 16 наиболее распространенных солидных раках в США, подтвердили, что количество раковых лимфатических узлов является основным предиктором смерти от рака. Исследователи также установили, что риск летального исхода пациентов постоянно возрастал по мере увеличения числа метастатических лимфатических узлов.
"Эти результаты важны, поскольку они могут потенциально улучшить и упростить процесс стадирования большинства солидных раковых опухолей", - заявил соавтор исследования Энтони Нгуен. "Подсчет лимфатических узлов возможен практически во всех медицинских учреждениях, включая страны с ограниченными ресурсами, без увеличения затрат для врача или пациента. Он также объективен и конкретен - почти все специалисты-патологи могут посмотреть на лимфатические узлы и согласиться с тем, сколько из них являются раковыми". Нгуен добавил, что процесс стадирования узлов может улучшить лечение и прогностическую информацию для пациентов, предоставляя более точный отчет о течении и вероятном исходе их заболевания.
"У пациента с 10 или более раковыми лимфатическими узлами прогноз будет кардинально отличаться от прогноза пациента с одним положительным лимфатическим узлом", - сказал Нгуен. "Это должно учитываться при общем стадировании".
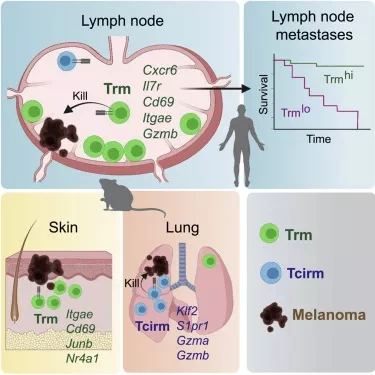
Исторически врачи признавали, что злокачественные опухоли часто распространяются в местные лимфатические узлы, прежде чем распространиться в другие части тела. Метастатические лимфатические узлы также ассоциируются с худшими результатами выживания почти при всех солидных видах рака, включая рак молочной железы, легких, колоректальный рак, рак простаты, меланому, рак головы и шеи.
Хотя статус узлов представляет собой один из краеугольных камней, на которых строится современное стадирование рака, он остается весьма изменчивым при различных формах заболевания, отметил Нгуен. Например, стадирование рака молочной железы в значительной степени зависит от количества раковых лимфатических узлов, в то время как при стадировании других видов рака используются размеры опухоли, ее расположение и распространение за пределы лимфатических узлов.
"Согласно общепринятому мнению, узловые метастазы ведут себя по-разному при различных видах рака, что объясняет различные системы стадирования, используемые для каждого вида рака", - говорит Зумстег. "Хотя это правда, что рак молочной железы отличается от рака простаты, наше исследование показало, что в поведении лимфатических узлов между видами рака больше сходства, чем различий". В ходе исследования было проведено комплексное изучение стадирования узлов при всех распространенных солидных раках, а не изолированное изучение одного типа рака, как это делалось на протяжении десятилетий".
Хотя результаты исследования многообещающие, исследователи также указывают на его ограничения. Главным из них является то, что данные касаются только выживаемости, а не рецидивов рака и метастазов, пояснил Зумстег. "Нам нужны более подробные данные о рецидивах и необходимо понять промежуточный этап: почему количество положительных лимфатических узлов приводит к распространению рака и летальному исходу? Что происходит между операцией и смертью? У пациентов с большим количеством положительных лимфатических узлов больше рецидивов в самих лимфатических узлах, больше рецидивов в других отдаленных локализациях или и то, и другое?"
В краткосрочной перспективе исследователи надеются повысить осведомленность всех сообществ, чтобы можно было внедрить систему узлового стадирования, говорят исследователи. "Узловые стадии дают информацию о том, как лечить пациентов с раком головы и шеи, например, с помощью операции, химиотерапии или облучения, или всех трех методов", - сказал Зумстег. "Это важный фактор, который определяет лечение всех видов рака. Совершенствование стадирования может улучшить эти решения о назначении терапии".
Anthony T Nguyen et al. Количественные показатели узлового бремени и летальности при солидных раках (аннотация).
Системы стадирования узловых образований существенно различаются в различных солидных опухолях, что подразумевает неоднородность поведения узловых переменных в различных контекстах. Мы предположили, что, вопреки этому, количество метастатических лимфатических узлов (ЛУ) является универсальным и доминирующим предиктором исхода при солидных опухолях.
Методы
Мы провели ретроспективный когортный анализ 1 304 498 пациентов из National Cancer Database, прооперированных в период с 2004 по 2015 год по 16 локализациям солидных опухолей. Для моделирования связи между количеством узлов и летальностью был построен многомерный регрессионный анализ Кокса с использованием ограниченных кубических сплайнов. Рекурсивный анализ разбиения (RPA) был использован для получения систем классификации узлов для каждого солидного рака на основе количества метастатических ЛУ. Воспроизводимость этих результатов была оценена на 1 969 727 пациентах из реестра Surveillance, Epidemiology and End Results. Для всех статистических анализов использовались двухсторонние тесты.
Результаты
Риск смертности постоянно возрастал с увеличением числа метастатических ЛУ (P < .001 для всех сегментов сплайна). Каждая система классификации узлов, полученная с помощью RPA, дала несколько прогностических групп, охватывающих широкий спектр риска смертности (P < .001). Многовариантные модели с использованием этих классификаций узлов, полученных с помощью RPA, продемонстрировали улучшенную согласованность со смертностью по сравнению с моделями, использующими классификацию American Joint Committee on Cancer staging в местах, где классификация узлов не основана на количестве метастатических ЛУ. Каждая система классификации узлов, полученная с помощью RPA, была воспроизводима в большой валидационной когорте в отношении смертности от всех причин и смертности по конкретной причине (P < .001). Высокое количественное узловое бремя было единственной самой сильной переменной, связанной с опухолью, которая ассоциировалась со смертностью в 12 из 16 случаев заболевания.
Выводы
Количественное бремя метастатических ЛУ является основным фактором смертности при солидных раках и должно служить основой для патологического узлового стадирования солидных опухолей.