Т-клетки обычно хорошо справляются с уничтожением больных клеток. Но, похоже, они терпят неудачу, когда дело доходит до опухолевых клеток.
Недавно ученые выяснили, что тормозит эту иммунную функцию, как можно ослабить тормоз и усилить иммунный ответ против рака. Т-клетки - это спецназ иммунной системы. Их работа заключается в постоянном патрулировании крови, лимфатической системы, тканей и органов. Если они натыкаются на клетки, инфицированные или поврежденные патогенами, они уничтожают их. Они также могут распознавать и уничтожать раковые клетки. Проблема, однако, заключается в том, что опухолевые клетки находят способы избежать этой линии обороны. Исследователи во всем мире работают над тем, чтобы предотвратить эти маневры уклонения и использовать Т-клетки для целенаправленной иммунотерапии рака.
Исследователи под руководством доктора Армина Рема из Центра молекулярной медицины имени Макса Дельбрюка в Берлине выявили механизм, который опухолевые клетки используют, чтобы уклониться от иммунного ответа организма. "Во многих случаях опухолевые клетки считывают ген EBAG9. Затем клетки вырабатывают белок, который защищает их. Но EBAG9 также влияет на клетки иммунной системы, потому что Т-клетки тоже его производят. В Т-клетках EBAG9 подавляет секрецию ферментов, которые действуют как яд, убивая опухолевые клетки", - объясняет Рем.
В журнале JCI Insight, исследователи описывают, как они освободили этот тормоз у мышей: "Мы отключили ген EBAG9 и это означает, что мы смогли остановить выработку EBAG9 в Т-клетках и усилить иммунный ответ на рак на длительный срок".
Ученые уже знают, что раковые клетки могут перехитрить иммунные клетки. Эти знания привели к разработке ингибиторов контрольных точек - вида иммунотерапии, который уже используется в клинической практике. Ингибиторы контрольных точек не позволяют раковым клеткам обмануть Т-клетки и заставить их думать, что они безвредны. "Но EBAG9 дает раковым клеткам еще одну линию обороны против нашей иммунной системы", - говорит Рем. "Он обезоруживает иммунные клетки и не дает им выделять вещества, которые могут навредить раковым клеткам".
Рем и коллеги давно подозревали, что EBAG9 подавляет Т-клетки. В 2009 году группа Рема разработала мышиную модель, в которой исследователи отключили ген EBAG9. "Иммунная система мышей работала лучше без EBAG9, и они могли гораздо эффективнее бороться с инфекциями", - говорит Рем. Затем они скрестили мышей без EBAG9 с другой генетически модифицированной моделью мышей, у которых спонтанно развивалась лейкемия. "Мы наблюдали за этими дважды модифицированными мышами в течение длительного периода времени", - рассказывает Рем. "Их опухоли развивались гораздо медленнее, чем у мышей с EBAG9".
Авторы проверили влияние гена EBAG9 на Т-клетки с помощью секвенирования РНК единичных клеток и биоинформационных методов. Помимо подтверждения того, что EBAG9 подавляет ответ Т-клеток, данные также показали, что иммунный ответ на рак отличается от того, который вызывают инфекции.
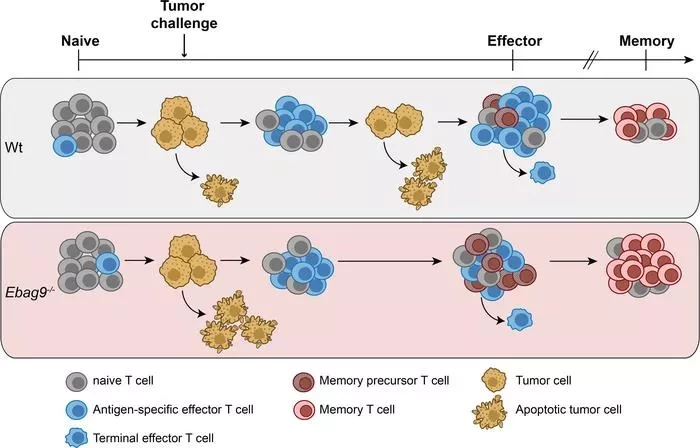
"Знания о том, как иммунная система развивает "память", получены на моделях инфекций. Их нельзя перенести 1:1 на опухоли", - говорит Рем. Т-клетки распознают больные или инфицированные клетки по сигнальным молекулам на их поверхности. Когда они обнаруживают эти вредные структуры, они дифференцируются на цитотоксические Т-клетки и Т-клетки памяти. Цитотоксические Т-клетки выделяют белки, которые проделывают отверстия в мембране клетки-мишени, чтобы проникнуть в нее и убить ее путем отравления. Инфицированная ткань также производит воспалительные сигнальные молекулы, такие как цитокины, которые вызывают больше Т-клеток и заставляют их созревать в Т-клетки памяти. Клетки памяти записывают иммунный ответ, чтобы иммунной системе не приходилось начинать все с нуля каждый раз, когда Т-клетки обнаруживают какое-либо заболевание.
Опухоли не вызывают воспаления на ранних стадиях. Ранее ученые предполагали, что это происходит потому, что Т-клетки не могут хорошо распознать опухолевые клетки. "Поскольку они вырабатываются организмом, опухолевые клетки имеют очень мало поверхностных молекул, которые можно идентифицировать как чужеродные", - отмечает Рем. Но похоже, что этих минимальных различий достаточно, чтобы Т-клетки распознали опухолевые клетки: когда исследователи отключили EBAG9, реакция была поразительной.
"Неингибированные Т-клетки уничтожают опухолевые клетки очень рано и очень радикально. Это также создает длительную защиту от опухолевых клеток. Чем сильнее первоначальная реакция Т-клеток, тем лучше их последующая память", - говорит Рем.
"Основываясь на этих результатах, мы теперь хотим разработать CAR Т-клетки без EBAG9 в качестве иммунотерапии лейкемии", - сообщает Рем. CAR означает химерный антигенный рецептор - искусственный рецептор, который распознает опухолевые клетки и встраивается в собственные Т-клетки пациента. Когда пациентам вводят CAR T-клетки, это оснащает их организм клетками, способными бороться с раком. Исследователи ожидают, что CAR T-клетки будут еще более эффективными без EBAG9. Хотя пройдет еще немало времени, прежде чем клетки достигнут стадии клинических испытаний, ожидание может стоить того:
"Мы не просто надеемся, что эта терапия приведет к более эффективному лечению лейкемии и лимфомы. Мы надеемся, что она поможет их вылечить", - говорит Рем.
Armin Rehm et al. EBAG9 контролирует формирование памяти CD8+ Т-клеток, реагирующих на опухоли у мышей (аннотация).
Понимание процессов, определяющих формирование памяти CD8+ Т-клеток, было получено на моделях инфекций. Эти модели ориентированы на воспалительную среду и часто используют высокоавидные CD8+ Т-клетки в процедурах адаптивного переноса. Неясно, имитируют ли эти условия процессы дифференцировки эндогенного репертуара, которые происходят в невоспалительных условиях, преобладающих в предзлокачественных опухолевых поражениях.
Мы изучили роль цитолитической способности на решения о судьбе CD8+ Т-клеток при праймировании опухолевыми клетками или минорными лейкоцитами, несовпадающими по антигену гистосовместимости. Приверженность CD8+ памяти была проанализирована у Ebag9-дефицитных мышей, которые демонстрировали усиленный лизис опухолевых клеток. Это свойство наделило Ebag9-/- мышей расширенным контролем прогрессирования хронической лимфоцитарной лейкемии, вызванной онкогеном Tcl-1. У Ebag9-/-мышей была получена расширенная популяция памяти для анти-HY и анти-SV-40 антиген-специфических Т-клеток, несмотря на неизменную частоту эффекторных клеток в первичном ответе. Сравнивая одноклеточные транскриптомы CD8+ Т-клеток, отвечающих на вакцинацию опухолевыми клетками, мы обнаружили дифференциальное распределение субпопуляций между Ebag9+/+ и Ebag9-/- Т-клетками. В клетках Ebag9-/- эти более крупные кластеры содержали гены, кодирующие транскрипционные факторы, регулирующие дифференцировку клеток памяти и функции антиапоптотических генов.
Полученные нами результаты связывают контролируемую EBAG9 цитолитическую активность и приверженность к линии памяти CD8+.