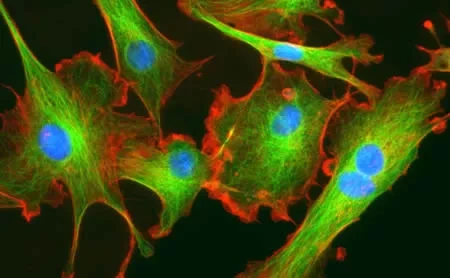
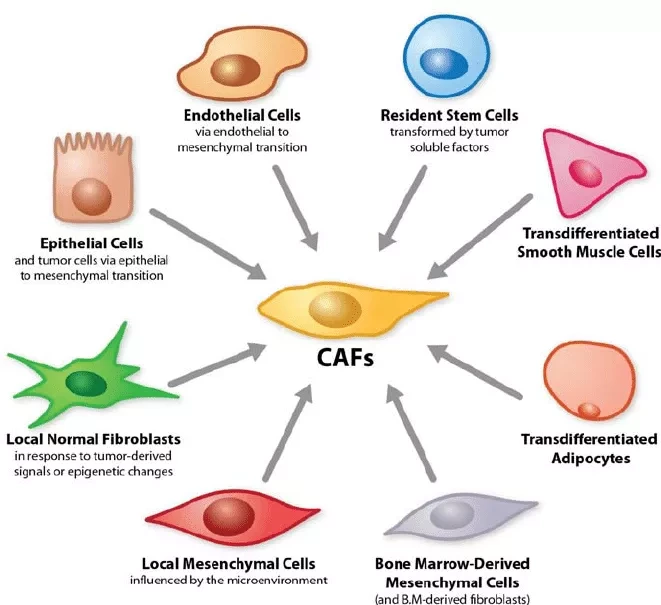
Группа экспертов из Университета Барселоны обнаружила механизм рекрутирования опухолеассоциированных клеток (раково-ассоциированных фибробластов или CAFs), которые необходимы для развития аденокарциномы легких, самого частого вида рака.
Это открытие очень актуально, поскольку раково-ассоциированные клетки участвуют во всех фазах развития опухоли, включая метастазирование. Исследование, опубликованное в British Journal of Cancer, показывает, что существует тип препарата-ингибитора, который может быть полезен против миграционных преимуществ этих раково-ассоциированных клеток, чтобы предотвратить их рекрутирование и, следовательно, их вклад в развитие опухоли.
"Важность этих результатов заключается в том, что аденокарцинома легких составляет 40% случаев рака легких, и она дает ранние метастазы, что напрямую влияет на шансы пациентов на выживание", - говорит координатор исследования Хорди Алькарас. Сейчас пятилетняя выживаемость при раке легких, не распространившемся на другие органы, составляет более 60%. Однако, когда он распространяется на другие части тела, эти шансы снижаются до менее 10%.
Алькарас в ходе предыдущих исследований установил, что белок SMAD3 избирательно гиперактивирован у пациентов с аденокарциномой. Новое исследование анализирует влияние белка SMAD3 на рекрутирование раково-ассоциированных клеток, а также его воздействие на распространение опухоли и образование метастаз. Авторы применили инновационную технологию на основе микрофлюидных устройств с 3D коллагеновыми внеклеточными матрицами для изучения распространения раковых клеток и миграции клеток в среде, имитирующей различные стадии развития опухоли.
Раковые клетки показали миграционное преимущество - более быстрое и направленное движение - в среде, типичной для ранних стадий рака. Кроме того, исследователи увидели в этих раково-ассоциированных клетках более низкую пролиферативную способность, что связано с промигрирующим эффектом SMAD3 как существенного фактора для набора и накопления CAFs в аденокарциноме. Поскольку эти раково-ассоциированные клетки участвуют во всех фазах развития опухоли - включая распространение - это открытие может иметь решающее значение для понимания раннего распространения аденокарциномы в другие органы. Кроме того, это миграционное преимущество было устранено ингибитором траметинибом - уже одобренным для использования при других типах опухолей, что способствует его терапевтическому использованию при аденокарциноме легких.
Исследователи "обнаружили, что клетки, ассоциированные с опухолью аденокарциномы, обладают высокой миграционной способностью. Это облегчает их проникновение в опухоль и может способствовать раннему образованию метастазов - процессу, который наблюдается у пациентов, но причины которого до сих пор неизвестны. Кроме того, ингибиторы, такие как траметиниб, согласно полученным результатам, могут быть эффективны против рекрутирования.
Авторы утверждают, что в среде, находящейся вблизи более развитой опухоли, аденокарцинома-ассоциированные клетки могут устанавливать более тесное взаимодействие с опухолевыми клетками из-за снижения миграционной способности, наблюдаемого в данном исследовании. "Мы продолжаем работу, чтобы понять, могут ли клетки, ассоциированные с аденокарциномой легких, также способствовать распространению этих опухолей с помощью других механизмов, с конечной целью обуздать их метастазирование".
Yago Juste-Lanas et al. 3D модели миграции коллагена показывают SMAD3-зависимый и TGF-β1-независимый механизм рекрутирования опухоль-ассоциированных фибробластов в аденокарциноме легких (аннотация).
Транскрипционный фактор TGF-β1 SMAD3 эпигенетически подавлен в опухоль-ассоциированных фибробластах (TAFs) из плоскоклеточной карциномы легких (SCC), но не из аденокарциномы (ADC) пациентов, что вызывает компенсаторное увеличение SMAD2, которое делает SCC-TAFs менее фиброзными. В данном исследовании мы изучили влияние изменения SMAD2/3 на миграцию фибробластов и его воздействие на формирование десмопластической стромы при раке легкого.
Методы
Мы использовали микрофлюидное устройство для изучения дескрипторов ранних протрузий и последующей миграции в трехмерных коллагеновых гелях при нокауте SMAD2 или SMAD3 с помощью shRNA в контрольных фибробластах и TAFs.
Результаты
В условиях высокого уровня SMAD3, как в фибробластах shSMAD2 и ADC-TAFs, наблюдалось миграционное преимущество в плане протрузий (меньше и длиннее) и миграции (быстрее и направленнее) избирательно без TGF-β1 наряду с гиперактивацией Erk1/2. Эта усиленная миграция отменялась TGF-β1, а также средой с низким содержанием глюкозы и ингибитором MEK траметинибом. Напротив, фибробласты с высоким уровнем SMAD2 плохо реагировали на TGF-β1, высокую глюкозу и траметиниб, демонстрируя ухудшение миграции во всех условиях.
Выводы
Преимущество фибробластов с высоким уровнем SMAD3 в отношении базовой миграции обеспечивает прямой механизм, лежащий в основе большего накопления TAFs, о которых уже сообщалось при ADC по сравнению с SCC. Более того, наши результаты поощряют использование ингибиторов MEK в случае ADC-TAFs, но не SCC-TAFs.