Врожденная иммунная система играет важнейшую роль в регулировании взаимодействия хозяина и микроорганизмов, и особенно в обеспечении защиты от патогенов, которые вторгаются в слизистую оболочку.
Используя модель кишечной инфекции, ученые из Института Пастера обнаружили, что врожденные эффекторные клетки - врожденные лимфоидные клетки 3-й группы - действуют не только на ранних стадиях инфекции, но и могут быть обучены для развития врожденной формы иммунологической памяти, которая может защитить хозяина при повторной инфекции. Исследование было опубликовано в журнале Science 25 февраля 2022 года.
Борьба с инфекциями Escherichia coli, которые вызывают кишечные заболевания или желудочно-кишечные кровотечения, является важной задачей здравоохранения. Эти бактерии, присутствующие в питьевой воде или продуктах питания, могут вызывать стойкую диарею, связанную с острым воспалением кишечника. В результате, энтеропатогенная и энтерогеморрагическая кишечная палочка ответственна почти за 9% детских смертей во всем мире.
Слизистая оболочка кишечника содержит сложную систему защиты, которая позволяет ей бороться с патогенной инфекцией, сохраняя толерантность к комменсальной микробиоте, необходимой для нормального функционирования организма. Этот постоянный контроль осуществляется врожденной иммунной системой, которая обеспечивает раннюю защиту в первые часы после заражения. Затем адаптивная иммунная система формирует память о патогенах, с которыми она сталкивается, активируя специфические рецепторы, экспрессируемые на поверхности В- и Т-лимфоцитов, что позволяет вырабатывать защитные антитела и воспалительные цитокины. В отличие от четко установленной функции адаптивной системы в долгосрочной толерантности и защите, роль врожденной системы в иммунной памяти еще предстоит выяснить.
В 2008 году группа под руководством ученого Джеймса Ди Санто (отдел врожденного иммунитета Института Пастера/Inserm) описала врожденные лимфоидные клетки группы 3 (ILC3s) как новое семейство лимфоцитов, которые отличаются от адаптивных Т- и В-лимфоцитов. ILC3s играют важную роль во врожденном иммунном ответе, особенно в слизистой оболочке кишечника, вырабатывая провоспалительные цитокины, такие как интерлейкин (IL)-22. Высвобождение цитокинов активирует выработку антимикробных пептидов эпителиальными клетками, тем самым снижая бактериальную нагрузку для поддержания целостности кишечного барьера.
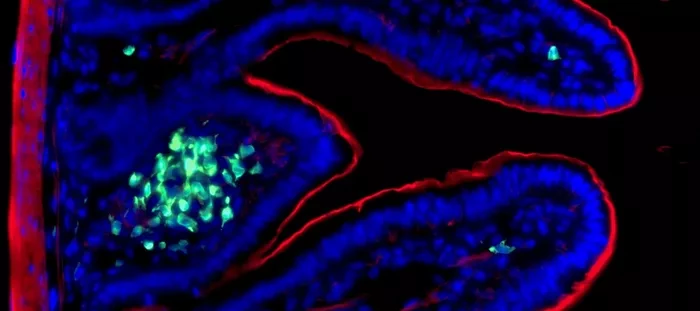
В данном исследовании ученые использовали инновационный протокол, чтобы подвергнуть иммунную систему ограниченному по времени энтеробактериальному воздействию Citrobacter rodentium (мышиная модель инфекции E. coli). Они заметили, что ILC3 сохраняются в активированном состоянии в течение нескольких месяцев после воздействия C. rodentium. Во время повторной инфекции "обученные" ILC3 обладают превосходной способностью контролировать инфекцию за счет усиленной пролиферации и массивной выработки IL-22.
"Наше исследование демонстрирует, что кишечные ILC3 приобретают память, чтобы со временем укрепить защитные силы слизистой оболочки кишечника против повторных инфекций",
- объясняет Николя Серафини, первый автор исследования. "Способность "тренировать" врожденную иммунную систему в слизистой открывает путь к улучшению защиты организма от различных патогенов, вызывающих заболевания человека", - комментирует Джеймс Ди Санто. Это открытие демонстрирует новый механизм антибактериальной иммунной защиты и в перспективе может привести к созданию новых терапевтических подходов для лечения воспалительных заболеваний кишечника или рака.
Nicolas Serafini et al. Обученные ответы ILC3 способствуют защите кишечника (аннотация).
Врожденные лимфоидные клетки группы 3 (ILC3s) являются эффекторами врожденного иммунитета, которые вносят свой вклад в защиту хозяина. Остаются ли функции ILC3 стабильно измененными после встречи с патогеном, неизвестно. В данном исследовании мы оценили влияние ограниченного по времени энтеробактериального вызова на долгосрочную активацию ILC3 у мышей. Мы обнаружили, что после воздействия Citrobacter rodentium кишечные ILC3 сохраняются в активированном состоянии в течение нескольких месяцев. При повторном вызове эти "обученные" ILC3 пролиферируют, демонстрируют усиленный ответ на интерлейкин-22 (IL-22) и обладают более высокой способностью контролировать инфекцию по сравнению с наивными ILC3. Метаболические изменения происходят в ILC3, подвергшихся воздействию C. rodentium, но только обученные ILC3 обладают повышенной пролиферативной способностью, что способствует увеличению продукции IL-22.
Таким образом, ограниченный контакт с патогеном может способствовать стойким фенотипическим и функциональным изменениям в кишечных ILC3, которые вносят вклад в долгосрочную защиту слизистой оболочки.