Исследователями разработан новый способ значительно повысить эффективность практически любой вакцины.
Ученые Международного института нанотехнологий при Северо-Западном университете США использовали химию и нанотехнологии для изменения структурного расположения адъювантов и антигенов на наноразмерной вакцине и внутри нее, что значительно повысило эффективность вакцины. Антиген нацелен на иммунную систему, а адъювант является стимулятором, повышающим эффективность антигена. Исследование опубликовано 30 января в журнале Nature Biomedical Engineering.
"Работа показывает, что структура вакцины, а не только ее компоненты, является критическим фактором в определении эффективности вакцины. То, где и как мы размещаем антигены и адъюванты в рамках единой архитектуры, заметно меняет то, как иммунная система распознает и обрабатывает их", - рассказал ведущий автор Чад А. Миркин.
По словам Миркина, это новое внимание к структуре может повысить эффективность обычных противораковых вакцин, которые исторически работали не очень эффективно. На сегодняшний день сотрудники Миркина изучили влияние структуры вакцины в контексте семи различных типов рака, включая трижды негативный рак молочной железы, рак шейки матки, вызванный папилломавирусом, меланому, рак толстой кишки и рак простаты, чтобы определить наиболее эффективную архитектуру для лечения каждого заболевания.
В большинстве обычных вакцин антиген и адъювант смешиваются и вводятся пациенту. Нет контроля над структурой вакцины, и, следовательно, ограничен контроль над транспортировкой и обработкой компонентов вакцины. Таким образом, нет контроля над тем, насколько хорошо работает вакцина. "Проблема обычных вакцин заключается в том, что из этой мешанины иммунная клетка может уловить 50 антигенов и один адъювант или один антиген и 50 адъювантов", - считает автор Миркин. "Но должно быть оптимальное соотношение каждого из них, которое бы максимизировало эффективность вакцины".
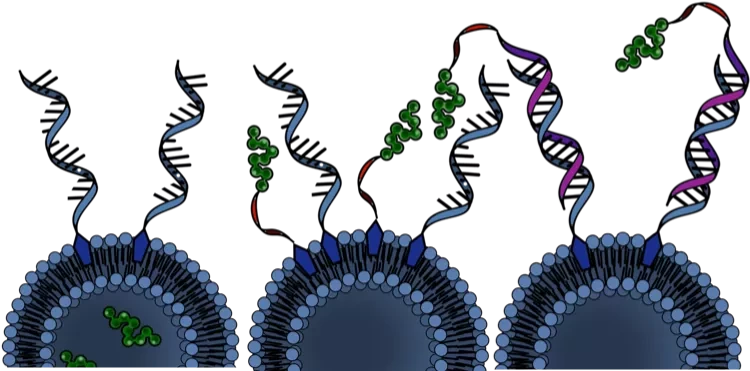
В этом новом классе модульных вакцин используются SNA (сферические нуклеиновые кислоты), которые являются структурной платформой, изобретенной и разработанной Миркиным, что позволяют ученым точно определить, сколько антигенов и адъювантов доставляется в клетки. SNA также позволяют ученым адаптировать способ представления этих компонентов вакцины и скорость их обработки. Такие структурные аспекты, которые в значительной степени влияют на эффективность вакцины, в основном игнорируются в традиционных подходах. Этот подход к систематическому контролю расположения антигенов и адъювантов в модульных архитектурах вакцин был разработан Миркиным, который ввел для его описания термин "рациональная вакцинология". Он основан на концепции, что структурное оформление компонентов вакцины так же важно для обеспечения эффективности, как и сами компоненты.
"Вакцины, разработанные на основе рациональной вакцинологии, доставляют точную дозу антигена и адъюванта каждой иммунной клетке, так что все они в равной степени готовы атаковать раковые клетки", - говорит Миркин. Если ваши иммунные клетки - это солдаты, то традиционная вакцина оставляет некоторых из них безоружными; наша вакцина вооружает их всех мощным оружием для уничтожения рака". Так каких же "солдат" иммунных клеток вы хотите, чтобы они атаковали ваши раковые клетки?", - риторически спрашивает Миркин.
Группа разработала вакцину против рака, которая удвоила количество раковых антиген-специфических Т-клеток и увеличила активацию этих клеток на 30%, изменив архитектуру вакцины таким образом, чтобы она содержала множество мишеней, помогающих иммунной системе находить опухолевые клетки. Команда исследовала различия в том, насколько хорошо два антигена распознаются иммунной системой в зависимости от их расположения - на ядре или периметре - структуры SNA. Для SNA с оптимальным размещением они могли увеличить иммунный ответ и то, как быстро нановакцина запускала производство цитокинов для усиления Т-клеток, атакующих раковые клетки. Ученые также изучили, как различные варианты размещения влияли на способность иммунной системы запоминать захватчика, и была ли эта память долгосрочной.
"То, где и как мы размещаем антигены и адъювант в рамках одной архитектуры, заметно меняет то, как иммунная система распознает и обрабатывает их",
- утверждает Миркин. Данные исследования показывают, что присоединение двух различных антигенов к SNA, содержащей оболочку из адъюванта, является самым мощным подходом для создания структуры вакцины против рака. Он привел к 30% увеличению активации антиген-специфических Т-клеток и удвоил количество пролиферирующих Т-клеток по сравнению со структурой, в которой те же два антигена были прикреплены к двум отдельным SNA. Эти разработанные наноструктуры SNA остановили рост опухоли в нескольких животных моделях. "Это поразительно", - отмечает Миркин. "При изменении расположения антигенов в двух почти одинаковых по составу вакцинах резко меняется эффективность лечения опухолей. Одна вакцина является мощной и полезной, а другая - гораздо менее эффективной".
Многие современные вакцины против рака разработаны для активации в первую очередь цитотоксических Т-клеток - только одного средства защиты от раковой клетки. Поскольку опухолевые клетки постоянно мутируют, они могут легко ускользнуть от надзора иммунных клеток, что быстро делает вакцину неэффективной. Шансы на то, что Т-клетка распознает мутирующую раковую клетку, выше, если у нее есть больше способов - несколько антигенов - распознать ее.
"Вам нужно активировать более одного типа Т-клеток, чтобы легче было атаковать опухолевую клетку", - говорит Миркин. Чем больше типов клеток у иммунной системы для борьбы с опухолями, тем лучше". Вакцины, состоящие из нескольких антигенов, нацеленных на несколько типов иммунных клеток, необходимы для того, чтобы вызвать усиленную и длительную ремиссию опухоли".
Еще одно преимущество подхода рациональной вакцинологии, особенно при использовании таких наноструктур, как SNA, заключается в том, что структуру вакцины легко изменить для борьбы с другим типом заболевания. По словам Миркина, они просто меняют пептид - фрагмент ракового белка с химической ручкой, которая "прикрепляется" к структуре, что напоминает добавление нового брелка к цепочке браслета. "Совокупная важность этой работы заключается в том, что она закладывает основу для разработки наиболее эффективных форм вакцин практически от любого вида рака", - сказал Миркин. "Речь идет о пересмотре методов разработки вакцин, включая вакцины против инфекционных заболеваний".
В ранее опубликованной работе Миркин и коллеги продемонстрировали важность структуры вакцины COVID-19, создав вакцины, которые продемонстрировали защитный иммунитет у 100% животных против смертельной вирусной инфекции. "Небольшие изменения в размещении антигена в вакцине значительно повышают межклеточную коммуникацию, перекрестный контакт и синергию клеток", - подчеркнул Миркин. "Разработки, сделанные в рамках данного исследования, открывают путь к переосмыслению дизайна вакцин против рака и других заболеваний в целом".
Teplensky, M.H., et al. Мультиантигенные вакцины против рака на основе сферических нуклеиновых кислот (аннотация).
Вакцины против рака должны активировать множество типов иммунных клеток, чтобы быть эффективными против агрессивных опухолей.
В данном исследовании мы сообщаем о влиянии структурного расположения двух антигенных пептидов на иммунный ответ на транскриптомном, клеточном и организменном уровнях. Мы использовали наночастицы сферических нуклеиновых кислот (SNA) для изучения того, как пространственное распределение и расположение двух классов антигенов влияет на обработку антигенов, выработку цитокинов и индукцию памяти. По сравнению с SNA с одним антигеном, одна SNA с двумя антигенами вызывала 30%-ное увеличение активации антиген-специфических Т-клеток и двукратное увеличение пролиферации Т-клеток. Размещение антигена в SNA с двумя антигенами изменяло экспрессию генов Т-клеток и рост опухоли. В частности, двухантигенные SNA, содержащие антигены, направленные на хелперные Т-клетки, и конъюгированные с внешними антигенами, направленными на цитотоксические Т-клетки, активизировали противоопухолевые генетические механизмы, останавливая опухоли лимфомы у мышей. Кроме того, в сочетании с ингибиторами контрольных точек антипрограммированного клеточного белка-1 в мышиной модели меланомы, специфическое расположение антигенов в двухантигенных SNA подавляло рост опухоли и повышало уровень циркулирующих Т-клеток памяти. Структурный дизайн мультиантигенных вакцин существенно влияет на их эффективность.