Как и в случае с сорняками в саду, полностью избавиться от раковых клеток в организме после их появления очень сложно.
У них есть неумолимая потребность постоянно разрастаться, даже когда их количество значительно сокращается в результате терапии или хирургического вмешательства. Даже несколько раковых клеток могут дать начало новым колониям, которые со временем перерастут свои границы и истощат местные ресурсы. Они также склонны забредать туда, где им не рады, создавая метастатические колонии в отдаленных местах, которые еще труднее обнаружить и уничтожить.
Одно из объяснений того, почему раковые клетки могут противостоять этой негостеприимной среде и условиям роста, заключается в старой пословице: "Что их не убивает, то делает их сильнее".
На самой ранней стадии формирования опухоли, еще до того, как рак может быть диагностирован, отдельные раковые клетки обычно оказываются в среде, лишенной питательных веществ, кислорода и адгезивных белков, которые помогают им прикрепляться к участку тела для роста. В то время как большинство раковых клеток быстро погибают, столкнувшись с такими негостеприимными условиями, небольшой процент может адаптироваться и приобрести способность инициировать колонию опухоли, которая в конечном итоге превратится в злокачественное заболевание.
Мы - исследователи, изучающие, как эти стрессы микросреды влияют на возникновение и развитие опухоли. (Авторы - ученые из Университета Калифорнии, Сан-Диего, прим.ред.). В нашем новом исследовании мы обнаружили, что суровая микросреда организма может подтолкнуть определенные раковые клетки к преодолению стресса изоляции и сделать их более искусными в инициировании и формировании новых опухолевых колоний. Более того, эти раковые клетки могут еще лучше адаптироваться в негостеприимных и стрессовых условиях, с которыми они сталкиваются при попытке образования метастазов в других областях тела или после того, как они подвергаются химиотерапевтическому или хирургическому лечению.
Раковые клетки преодолевают стресс изоляции
Мы сосредоточились на раке поджелудочной железы, одном из самых смертоносных видов рака, который, как известно, устойчив к химиотерапии и часто не поддается хирургическому лечению. Почти 90% пациентов с раком поджелудочной железы погибают от рецидива рака или метастаз в течение пяти лет после постановки диагноза.
Мы хотели изучить, как на образование опухоли влияет так называемый "стресс изоляции", когда клетки лишены питательных веществ или кислорода из-за плохого формирования кровеносных сосудов или из-за того, что они не могут получить пользу от контакта с близлежащими раковыми клетками. Чтобы изучить, как раковые клетки реагируют на такие ситуации, мы воссоздали различные формы стресса изоляции в культурах клеток, на мышах и в образцах пациентов, лишая их кислорода и питательных веществ или подвергая воздействию химиотерапевтических препаратов. Затем мы определили, какие гены были включены или выключены в клетках рака поджелудочной железы.
Мы обнаружили, что клетки рака поджелудочной железы, подвергнутые условиям, имитирующим изоляционный стресс, приобретают на своей поверхности новый рецептор, которого обычно нет у не подверженных стрессу раковых клеток: рецептор лизофосфатидной кислоты 4, или LPAR4, белок, участвующий в прогрессии опухоли.
Когда мы заставили раковые клетки вырабатывать LPAR4 на своей поверхности, мы обнаружили, что они способны образовывать новые опухолевые колонии в два-восемь раз быстрее, чем обычные раковые клетки в условиях изолированного стресса. Кроме того, предотвращение получения раковыми клетками LPAR4 в условиях стресса снижало их способность образовывать опухолевые колонии на 80-95%. Эти результаты свидетельствуют о том, что способность раковых клеток получать LPAR4 при воздействии стресса является необходимой и достаточной для развития опухоли.
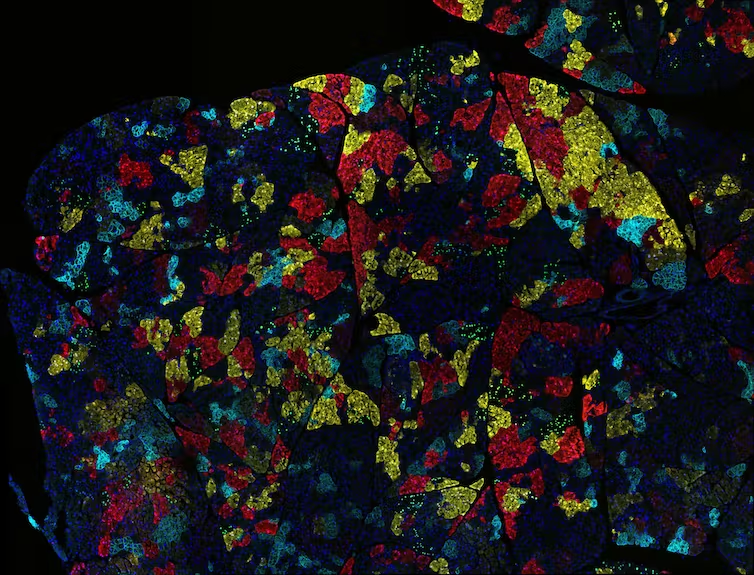
Опухоли содержат множество различных типов раковых клеток с уникальными генетическими мутациями. На этом изображении показаны различные скопления клеток рака поджелудочной железы, каждое из которых имеет свой цвет, внутри опухоли. Ravikanth Maddipati, Abramson Cancer Center at the Univ. of Pennsylvania, National Cancer Institute, National Institutes of Health via Flickr, CC BY-NC.
Как LPAR4 помогает создавать опухоли?
Мы также обнаружили, что LPAR4 помогает раковым клеткам инициировать опухоль, давая им способность производить сеть макромолекул, или внеклеточный матрикс, который обеспечивает им адгезивную опору в негостеприимной среде. Производя ореол из собственного матрикса, раковые клетки с LPAR4 могут начать строить свою собственную нишу, поддерживающую опухоль, которая обеспечивает им убежище от изолирующих стрессов.
Мы определили, что ключевым компонентом этого внеклеточного матрикса является фибронектин. Когда этот белок связывается с рецепторами, называемыми интегринами, на поверхности клеток, он запускает каскад событий, в результате которых происходит экспрессия новых генов, способствующих возникновению опухоли, устойчивости к стрессу и прогрессированию рака. В конце концов, другие раковые клетки привлекаются в сеть матрикса, богатого фибронектином, и начинает формироваться новая колония опухоли-сателлита. Учитывая, что опухолевые клетки с LPAR4 могут быстро создавать свой собственный матрикс, поддерживающий опухоль, это позволяет предположить, что LPAR4 может позволить отдельным опухолевым клеткам преодолеть стресс изоляции и выжить в кровотоке, лимфатической системе, участвующей в иммунных реакциях, или в отдаленных органах в виде метастазов.
Важно отметить, что мы обнаружили, что стресс изоляции - не единственный способ запустить LPAR4. Воздействие на клетки рака поджелудочной железы химиотерапевтических препаратов, которые предназначены для создания стресса для раковых клеток, также вызывает увеличение LPAR4 на раковых клетках. Этот результат может объяснить, как такие опухолевые клетки могут развивать устойчивость к лекарственным препаратам.
Удержание раковых клеток в состоянии стресса
Понимание того, как прервать каскад событий, позволяющих раковым клеткам стать устойчивыми к стрессу, очень важно, поскольку это дает новую область для изучения будущих методов терапии.
В настоящее время наша исследовательская группа рассматривает потенциальные стратегии, позволяющие предотвратить использование раковыми клетками фибронектинового матрикса для достижения стрессоустойчивости, включая препараты, которые могут быть нацелены на рецепторы, связывающиеся с фибронектином на поверхности опухолевых клеток. Один из таких препаратов, разрабатываемый компанией, соучредителем которой является один из нас, скоро начнет клинические испытания. Другие стратегии включают предотвращение того, чтобы раковые клетки получали LPAR4, когда они чувствуют стресс, или вмешательство в сигналы, которые способствуют образованию фибронектинового матрикса.
Для пациентов с диагнозом рак поджелудочной железы существует острая необходимость в поиске способов повышения эффективности хирургического вмешательства или химиотерапии. Подобно борьбе с сорняками в вашем саду, это может потребовать одновременной атаки на проблему с нескольких направлений.