Восстановление поврежденной ДНК, по-видимому, стимулирует старение, вызывая потерю эпигенетической информации, но восстановление этой информации обращает этот эффект вспять, показало исследование.
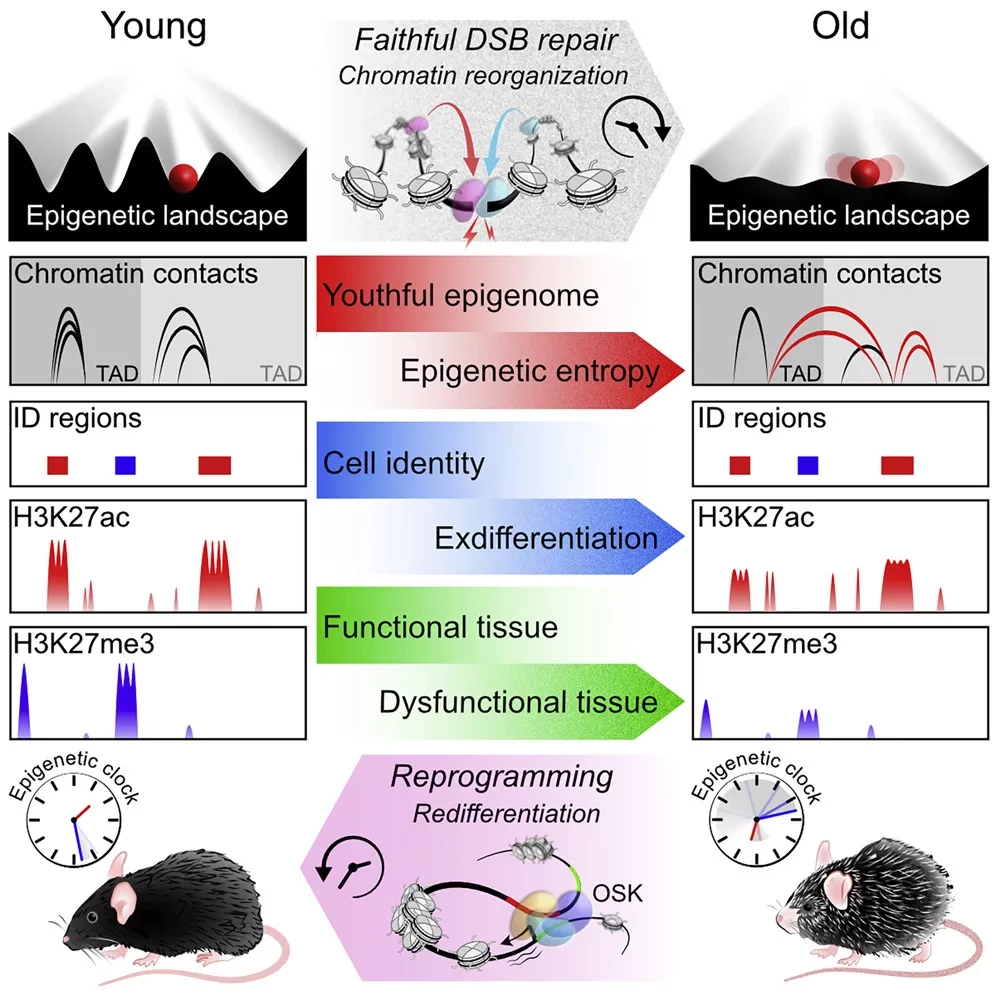
По мере старения клетки млекопитающих накапливают различные эпигенетические сигнатуры - например, вариации в паттернах метилирования ДНК. Однако до сих пор остается неясным, являются ли они причиной или следствием старения. Исследование, опубликованное 12 января в журнале Cell, доказывает, что эпигенетические нарушения сами по себе ускоряют молекулярное, физиологическое и нейрокогнитивное старение мышей, и что это обусловлено клеточным ответом на повреждения ДНК, такие как двунитевые разрывы (DSBs). Активируя специфические гены, высоко экспрессируемые во время развития млекопитающих, исследователи смогли восстановить эпигенетический ландшафт, нарушенный процессом восстановления ДНК в модели стареющей мыши, что привело к признакам омоложения.
DSBs уже давно ассоциируются со старением. Поскольку эта тяжелая форма повреждения ДНК может привести к мутациям, некоторые исследователи предположили, что это последовательное накопление геномных изменений может быть основной причиной старения. Однако в последние десятилетия появились другие данные, свидетельствующие о том, что повреждение ДНК может быть связано со старением по другому механизму, не связанному с мутациями. Например, в 2008 году Дэвид Синклер, генетик из Центра биологии старения при Гарвардской медицинской школе, и его коллеги сообщили, что разрывы ДНК также приводят к эпигенетическим нарушениям, при которых белки, модифицирующие хроматин, перемещаются в места, где требуется восстановление ДНК. Эти перестройки вызывают постоянные эпигенетические изменения, которые, как предположили Синклер и его коллеги, могут накапливаться и способствовать старению клеток.
Теперь, в новом исследовании, Синклер и его коллеги проверили, вовлечена ли эта релокализация модификаторов хроматина в процесс старения. Для этого они создали трансгенную модель мыши, несущую эндонуклеазу слизистой плесени, которая при обработке препаратом тамоксифен индуцирует в геноме животного разрывы ДНК, запускающие репарацию ДНК и приводящие к эпигенетическим изменениям. Важно отметить, что эти разрывы ДНК, индуцированные в системе, получившей название "ICE" (Inducible Changes to the Epigenome), не приводят к изменению частоты мутаций ДНК, что исключает возможность того, что любые наблюдаемые последствия ICE обусловлены мутациями. Это изящная и "элегантная система для индуцирования эпигенетического старения, то есть для создания DSBs в клетках и мышах, не вызывая мутаций", - отмечает исследователь старения Китайской академии наук Гуан-Хуэй Лю. "Я думаю, что авторы использовали остроумный метод для решения этой проблемы", - добавляет он.
Согласно исследованию, в возрасте 4-6 месяцев после трехнедельного воздействия тамоксифена на организм мышей с трансгенной эндонуклеазой и контрольных мышей не было заметно никаких различий. Однако через десять месяцев после курса воздействия "мы обнаружили множество фенотипов старения", таких как седые волосы, мышечная слабость и потеря памяти, говорит соавтор исследования, генетик Гарвардской медицинской школы Дже-Хьюн Янг, добавляя, что старение животных с ICE, по-видимому, было ускоренной формой нормального старения, поскольку они напоминали старых мышей дикого типа. Когда команда изучила эпигенетические часы, они также обнаружили, что у мышей ICE старение прогрессировало примерно на 50 % быстрее, чем у контрольных.
Используя ChIP-секвенирование, метод, который фиксирует взаимодействие белков с ДНК, команда заметила, что разрывы ДНК и последующее восстановление приводят к разрушению эпигенетического ландшафта. Это означает, что если в норме в клетках есть геномные области с высоким уровнем связанных с ними гистонов и другие области с меньшим количеством этих белков, объясняет Янг, то восстановление повреждений ДНК уменьшает эти сильные различия по всей ДНК клеток, что приводит к более ровному эпигенетическому ландшафту. Это, в некотором смысле, размывает идентичность клетки, что, в свою очередь, означает потерю функции, говорит Янг.
Наконец, авторы проверили, могут ли они изменить эпигеномный ландшафт у этих ICE-мышей. Для этого они вызвали экспрессию подгруппы факторов Яманаки - генов, способных перепрограммировать взрослые клетки в плюрипотентное состояние. Ранее группа Синклера и другие исследователи показали, что эти гены увеличивают продолжительность жизни мышей и излечивают слепоту. После пяти недель непрерывной экспрессии этих генов у мышей ICE исследователи обнаружили значительные признаки омоложения как на молекулярном, так и на тканевом уровне.
Эти результаты, а также результаты исследования 2020 года, в котором группа Синклера восстанавливала зрение у мышей, позволяют предположить, что существует
"резервная копия программного обеспечения, которую мы можем переустановить в клетки", - утверждает Синклер.
Иными словами, экспрессия генов Яманаки может каким-то образом вызвать в клетках доступ к хранящимся в них данным, которые сбрасывают эпигенетический ландшафт. "Но как это работает и где хранится информация, мы пока не знаем", - говорит он, добавляя, что "для нас это следующий большой вопрос, на который нужно ответить".
Концепция резервной копии "имеет смысл просто потому, что эпигенетическая информация сбрасывается каждый раз, когда зачинается новый ребенок", - утверждает Вера Горбунова из Университета Рочестера. "Скорее всего, информация закодирована в ДНК, но программа восстановления активируется только при определенных обстоятельствах (например, в развивающемся эмбрионе)", - добавляет Горбунова, которая не участвовала в этом исследовании, но рецензировала его.
Горбунова считает, что эти результаты потенциально могут быть воплощены в лечение для восстановления эпигенетической информации в клетках и тканях человека, но "мы просто должны найти очень безопасный способ сделать это". Синклер, который является консультантом и членом совета директоров нескольких биотехнологических компаний, говорит, что его команда в настоящее время работает над такой терапией: В 2017 году с этой целью он основал бостонскую компанию Life Biosciences. Он отмечает, что "на это уже потрачено много усилий [и] десятки миллионов долларов". Он добавляет, что в настоящее время компания сосредоточена на "исследованиях нечеловеческих приматов для улучшения зрения", и эти результаты появятся в ближайшие несколько месяцев. "Если это сработает, то следующим видом будет человек".
Если исследователям удастся безопасно манипулировать эпигенетическими ландшафтами у людей, продолжает он, "то, что мы сейчас считаем очень разными заболеваниями", такими как болезнь Альцгеймера, диабет, рак и болезни сердца, можно будет лечить "одним лекарством, и это то, к чему мы стремимся". Он утверждает, что "эти болезни исчезнут", если с помощью терапии удастся сделать "организм моложе... потому что все они являются проявлениями старения", и именно в этом, по его словам, заключается "главная задача - найти универсальную причину старения".
Jae-Hyun Yang et al. Потеря эпигенетической информации как причина старения млекопитающих (аннотация).
Все живые существа испытывают увеличение энтропии, проявляющееся в виде потери генетической и эпигенетической информации. У дрожжей эпигенетическая информация теряется со временем из-за релокализации белков, модифицирующих хроматин, к разрывам ДНК, в результате чего клетки теряют свою идентичность, что является отличительной чертой старения дрожжей. Используя систему под названием "ICE" (индуцируемые изменения эпигенома), мы обнаружили, что акт восстановления истинной ДНК способствует старению на физиологическом, когнитивном и молекулярном уровнях, включая эрозию эпигенетического ландшафта, клеточную эксдифференциацию, сенесценцию и сдвиг часов метилирования ДНК, который может быть обращен вспять OSK-опосредованным омоложением.
Эти данные согласуются с информационной теорией старения, которая утверждает, что потеря эпигенетической информации является обратимой причиной старения.