В ходе исследования было обнаружено, что иммунная система, следящая за раком, может сама вызывать метаболическую адаптацию в клетках опухолей на ранних стадиях, что одновременно способствует их росту и позволяет им супрессировать смертоносные иммунные реакции.
В исследовании, опубликованном в журнале Cell Metabolism под руководством члена-корреспондента Лозаннского университета Людвига Пинг-Чих Хо, подробно описывается точный механизм, с помощью которого происходит "иммунометаболическое редактирование" зарождающихся опухолей в мышиных моделях рака кожи - меланомы, и определяется новый биохимический сигнальный механизм и белки, которые обеспечивают его действие. Помимо освещения ранее неизвестного аспекта эволюции опухолей, полученные результаты открывают большие перспективы для повышения эффективности иммунотерапии рака.
"Мы обнаружили десятки метаболических ферментов, которые способствуют уклонению от иммунитета в опухолях меланомы. Эти ферменты, а также некоторые отдельные компоненты выявленного нами сигнального пути, представляют собой богатый арсенал потенциальных лекарственных мишеней, способных подорвать защиту, воздвигнутую иммунометаболическим редактированием. Такие препараты могут сделать опухоли уязвимыми для иммунной очистки, а также могут быть использованы в сочетании с блокадой контрольных точек и другими иммунотерапиями для преодоления устойчивости большинства раковых опухолей к таким методам лечения", рассказал Хо.
Считается, что надзор иммунной системы за раковыми клетками способствует развитию злокачественной опухоли, поскольку приводит к эволюции раковых клеток, которые могут подорвать механизм иммунного обнаружения и атаки. Эта теория "иммуноредактирования" в настоящее время является фундаментальным принципом иммунологии опухолей.
Исследователям также давно известно, что метаболические адаптации, характерные для раковых клеток - например, потребление ими глюкозы - подрывают противоопухолевые иммунные реакции. Однако оставалось неясным, может ли иммунный надзор также вызывать метаболические адаптации в раковых клетках и могут ли эти адаптации дополнительно помочь им противостоять иммунным реакциям. Именно это и было установлено в настоящем исследовании, раскрыв ту сторону эволюции опухолей, которая была предположена в гипотезе, но до сих пор оставалась недоказанной.
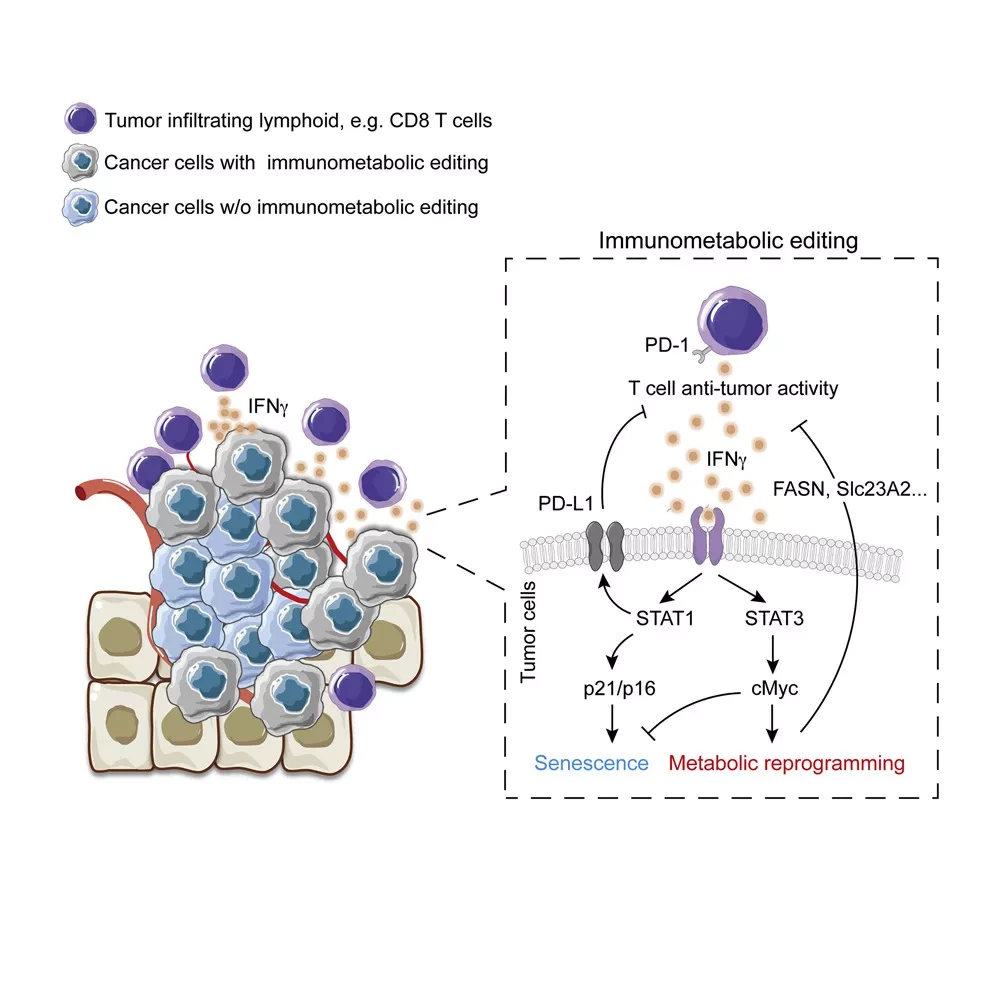
Хо и его коллеги выявили три ключевых белка, которые обеспечивают этот эффект: IFNγ, STAT3 и c-Myc. IFNγ - инструмент противоракового надзора, выделяемый Т-клетками и другими иммунными клетками и блокирующий рост раковых клеток. Но сигналы, которые он вызывает, опосредованные белком STAT1, также индуцируют адаптацию в раковых клетках, которая помогает им уклоняться от атаки Т-клеток - процесс, известный как иммуноредактирование.
В данном исследовании ученые показали, что IFNγ дополнительно активирует отдельный и малоизученный сигнальный путь, опосредованный родственным белком STAT3. Этот путь изменяет экспрессию генома раковой клетки, вызывая "эпигенетические" изменения, которые определяют, какие гены активны. Он также гиперактивирует главный регулятор клеточного метаболизма, известный как c-Myc, который сверхэкспрессируется во многих видах рака.
Исследователи показали, что гены, активированные c-Myc, не только определяют метаболизм рака, но и нарушают проникновение Т-клеток в опухоли и препятствуют их атаке на раковые клетки. Сигнальные пути, опосредованные STAT1 и STAT3, фактически, синергично наделяют возникающие опухоли критической способностью избегать иммунного клиренса, стимулируя иммунометаболическое редактирование, которое способствует их эволюции в полноценную злокачественную опухоль.
"Предыдущие исследования показали, что потеря активности STAT3 в раковых клетках способствует иммунной инфильтрации и вызывает регрессию опухоли", - рассказал Хо. "Наши результаты объясняют причину этого и позволяют предположить, что воздействие на STAT3 с помощью лекарственных препаратов может восстановить чувствительность к IFNγ в раковых клетках, которые развились за пределами его ингибирующей способности".
Исследователи также использовали CRISPR редактирование генома для скрининга 2 078 метаболических ферментов в опухолях мышей и выявили 40 метаболических генов, контролируемых c-Myc, которые играют важную роль в помощи раковым клеткам уклоняться от иммунного контроля и атаки. Эти ферменты также являются основными кандидатами для нацеливания лекарственных препаратов.
"Помимо фармакологических возможностей, - говорит Хо, - это исследование раскрывает ранее не оцененный аспект иммуноредактирования, который повлияет на наше понимание метаболического взаимодействия между раковыми клетками и иммунными клетками в микроокружении опухоли".
Tsai, C-H., et al. Иммуноредактирование направляет метаболическое перепрограммирование опухоли на поддержку иммунного уклонения (аннотация).
Иммуноредактирование формирует иммуногенность и препятствует противоопухолевым ответам хозяина в опухолевых клетках во время опухолеобразования; однако остается неизвестным, может ли метаболическое программирование опухолевых клеток направляться иммунонаблюдением.
В данной работе мы сообщаем, что опосредованный Т-клетками иммунонадзор на ранних стадиях опухолеобразования вызывает повышение уровня c-Myc и метаболическое перепрограммирование в опухолевых клетках. Это ранее не изученное взаимодействие опухоли и иммунитета контролируется неканонической сигнализацией интерферон гамма (IFNγ)-STAT3 и поддерживает иммунное уклонение опухоли.
Наши результаты показывают, что иммуноредактирование инструктирует дерегулированные биоэнергетические программы в опухолевых клетках, чтобы дать им возможность обезвредить опосредованный Т-клетками иммунонадзор путем навязывания метаболического перетягивания каната между опухолью и инфильтрирующими Т-клетками и формирования супрессивного микроокружения опухоли.