Исследование показало, что Т-клетки, индуцированные героином, пересекают гематоэнцефалический барьер и сеют хаос в мозге, что указывает на новые способы предотвращения абстинентного синдрома.
Исследователи раскрыли один из путей, по которому употребление опиоидов приводит к синдрому отмены, выявив ранее неизвестный путь в иммунной системе, который приводит к нестабильным и дисфункциональным связям между клетками мозга.
Хотя иммунную систему уже давно связывают с опиоидной абстиненцией, новые результаты, опубликованные 19 января в журнале Cell, являются первыми, которые связывают взаимодействие иммунной системы с центральной нервной системой и особенно с гематоэнцефалическим барьером с абстиненцией, объясняет исследователь иммунопатогенеза Луис Монтанер, профессор Института Вистара в Филадельфии, который не принимал участия в исследовании. Хотя некоторые выводы еще предстоит воспроизвести и проверить, Монтанер говорит, что исследование представляет ученым "дорожную карту для новых клинических вмешательств, которые необходимо протестировать", чтобы предотвратить абстиненцию и помочь людям, выздоравливающим от опиоидной зависимости, безопасно отвыкнуть от наркотика и избежать повторного употребления.
"Эта работа представляет собой значительный прогресс в развивающейся области нейро-иммунных взаимодействий и роли иммунных клеток и медиаторов в модуляции нейронных процессов при воздействии опиоидов", - говорит иммунолог из Университета Темпл и исследователь наркомании Тоби Эйзенштейн, которая также не принимал участия в исследовании. "Я думаю, что эта статья - действительно огромный шаг вперед". Эйзенштейн говорит, что ее заинтриговала статья, в которой симптомы абстиненции связываются с воспалительным иммунным ответом, поскольку, как она писала в обзорной статье 2019 года об иммунных эффектах морфина, десятилетия исследований показали, что опиоиды и иммунные клетки, о которых идет речь в новом исследовании, являются иммуносупрессивными.
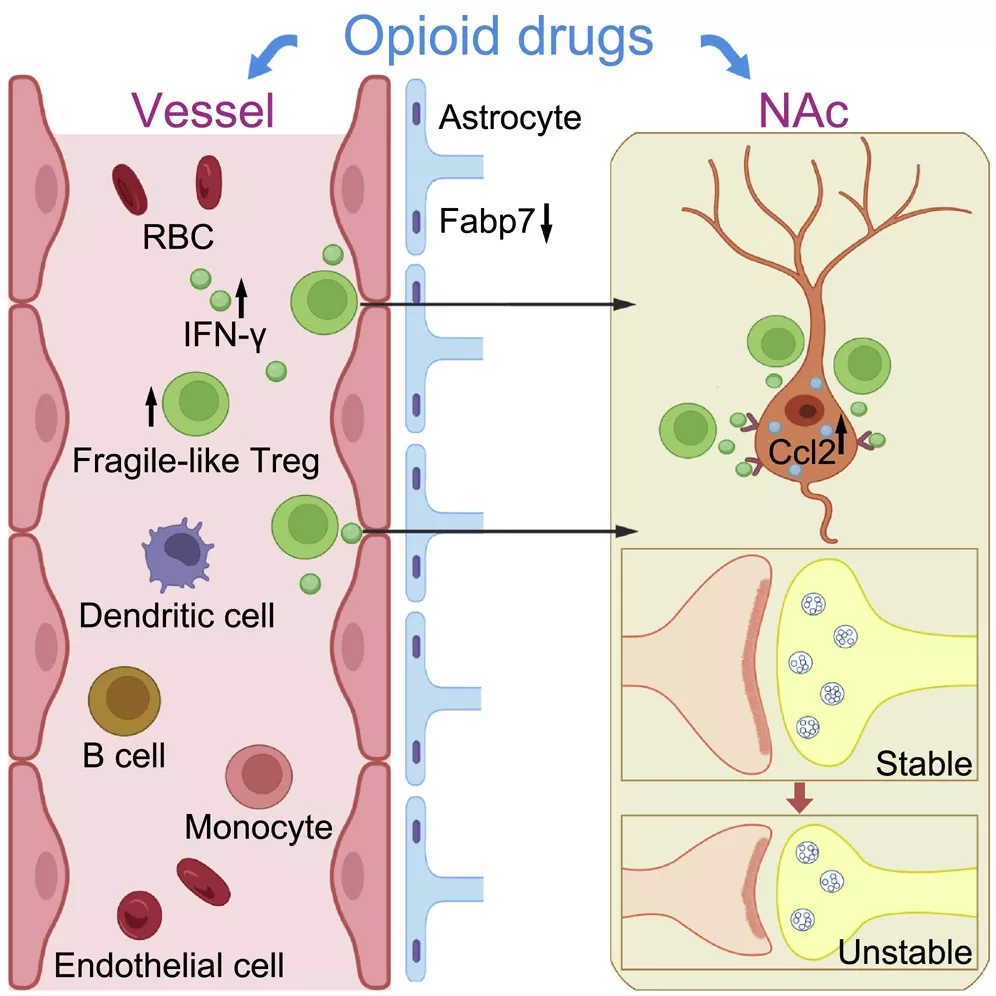
В ходе исследования ученые изучили кровь 21 человека, употребляющего героин, и сравнили ее с кровью 20 контрольных лиц, обнаружив, что в крови первой группы содержатся различные биомаркеры, указывающие на то, что их иммунная система находится в беспорядке. Проведя дальнейшее исследование с помощью серии экспериментов с использованием проточной цитометрии, они обнаружили, что в крови группы, употреблявшей героин, содержался высокий уровень необычных иммунных клеток, называемых хрупкими (уязвимыми) регуляторными Т-клетками (Tregs). Обычно Tregs участвуют в иммуносупрессии, но в этом уязвимом состоянии, которое ранее наблюдалось только в опухолевой микросреде, они теряют свои супрессивные функции и вместо этого производят воспалительный цитокин интерферон-γ (IFN-γ). Авторы исследования пишут, что причиной неожиданного состояния клеток могла стать гипоксия, вызванная опиоидами, поскольку гипоксия была связана с возникновением уязвимых состояний у Tregs вблизи опухолей.
Перейдя к мышиной модели, исследователи обнаружили, что лечение мышей героином привело к увеличению количества фрагментированных Treg и, следовательно, к повышению экспрессии IFN-γ в кровотоке. Анализ образцов, взятых у мышей, получавших героин, показал, что IFN-γ был более распространен не только в кровотоке, но и в nucleus accumbens, области мозга, которая модулирует поведение, направленное на достижение цели, и пути вознаграждения, что делает его важным для понимания и лечения зависимости.
По мнению авторов исследования, повышенный уровень IFN-γ в этой области указывает на то, что уязвимые Treg-клетки смогли пересечь гематоэнцефалический барьер. Авторы исследования связали эту уязвимость с отверстиями в гематоэнцефалическом барьере, вызванными экспрессией C-C-мотива хемокинового лиганда 2 (Ccl2) нейронами nucleus accumbens, чему способствовало воздействие опиоидов, и что увеличивало трафик Treg в мозг. Это особенно заинтересовало Эйзенштейн, говорит она: хемокины отвечают за перемещение подгрупп иммунных клеток, которые экспрессируют рецептор соответствующего хемокина, но тот факт, что экспрессия хемокинов происходит в мозге, указывает на то, что клетки мозга играют более важную роль в иммунном ответе, чем предполагалось ранее. "Я думаю, что эта статья действительно продвигает всю нейроиммунную область и, возможно, наше понимание того, что иммунные медиаторы и клетки делают в мозге", - утверждает Эйзенштейн.
Окрашивание показало, что уровни других цитокинов и воспалительных агентов не изменились, что, по мнению исследователей, означает, что уязвимые Treg-клетки (и, в частности, IFN-γ, который они экспрессировали) вызывали изменения в nucleus accumbens - ослабление синаптических связей между нейронами - что затем привело к симптомам абстиненции у мышей. Другими словами, как говорится в статье, "опиоидная стимуляция ... усиливает проникновение уязвимых Tregs в [центральную нервную систему] и тем самым способствует структурным и поведенческим изменениям".
Собрав механизм воедино, исследователи также показали, что они могут его разрушить, по крайней мере, у мышей. Как у мышей с нокаутом IFN-γ, так и у мышей, обработанных нейтрализующими IFN-γ антителами до начала лечения опиоидами, нейронные связи оставались крепкими и неизменными в течение всего периода абстиненции, даже несмотря на то, что хрупкие Treg-клетки по-прежнему проникали в мозг. В этих экспериментах у мышей наблюдалось уменьшение и сокращение продолжительности симптомов абстиненции - в одном случае на 12 часов вместо 60.
По словам Монтанера, главный вопрос, который остается открытым, заключается в том, может ли разрушение какого-либо одного звена в этой цепочке предотвратить симптомы абстиненции у людей так же хорошо, как это происходит у мышей. В связи с этим Монтанер говорит, что хотел бы увидеть долгосрочные исследования на людях, чтобы определить, предсказывает ли количество уяз хрупких Treg-клеток тяжесть и продолжительность синдрома отмены, как предполагает новое исследование.
В статье отмечается, что пока неясно, что именно приводит к увеличению количества фрагментарных Treg в крови потребителей героина - Монтанер отмечает, что в исследовании были взяты образцы у людей через несколько дней после прекращения употребления героина, что означает, что они уже начали испытывать абстиненцию, но не во время употребления опиоидов - это упущение затрудняет понимание начальных стадий процесса. Поэтому, по его словам, связывать наличие клеток с гипоксией - это некоторая экстраполяция со стороны авторов исследования, равно как и некоторые предположения, сделанные относительно опыта человеческих когорт в отношении абстиненции.
Эйзенштейн отмечает, что существует много литературы - она является соавтором многих из этих работ - показывающей, что употребление опиоидов и последующая абстиненция могут подавлять иммунную систему до такой степени, что патогенные кишечные бактерии проникают в организм, что приводит к сепсису. Хотя в новом исследовании не рассматривалась роль бактерий или сепсиса в абстиненции, Эйзенштейн предполагает, что эти два фактора могут быть потенциально связаны, и что, гипотетически говоря, сепсис на ранних стадиях абстиненции может вызвать или способствовать воспалительной реакции, которую авторы исследования наблюдали несколько дней спустя, когда они начали собирать данные.
"Я думаю, что их вывод, к которому они пришли, обоснован", - считает Эйзенштейн. "Но, возможно, есть и другая часть механизма, о которой они не подумали, и которая на самом деле является обратной по отношению к тому, на чем они остановились. Они говорят, что эти уязвимые Т-клетки индуцируются, затем перемещаются с периферии в nucleus accumbens, затем [экспрессируют] интерферон. Но, возможно, эти уязвимые Т-клетки индуцируются от самого факта сепсиса, опережая его".
Кроме того, результаты исследований причинно-следственной связи у мышей могут не соответствовать или не объяснять корреляцию, выявленную у людей, употребляющих героин, утверждает Ирма Циснерос, исследователь наркомании, которая изучает, как иммунные клетки центральной нервной системы реагируют на токсины и вирусы.
"На физиологическом уровне все взаимосвязано", - говорит Сиснерос. Например, ось "кишечник-мозг" или то, как метаболиты, образующиеся в печени в результате употребления и злоупотребления наркотиками, могут пересекать [гематоэнцефалический барьер]". Эта статья почти не затрагивает все эти аспекты, но связь между ними трудно уловить. Особенно учитывая, что одним из наиболее важных факторов, на мой взгляд, является нейроциркуляторная зависимость, которая не освещена в этой статье. Люди не употребляют наркотик в первый раз и не становятся зависимыми, это процесс и перестройка нейросхемы, которая приводит к зависимости. Более чем вероятно, что нейровоспаление влияет на эту нейросхему". Она добавляет, что схема мозга мышей может не полностью напоминать схему мозга человека, страдающего зависимостью, поскольку они получали героин, а не пристрастились к нему самостоятельно.
Тем не менее, если отбросить вопросы без ответов и предварительные гипотезы, исследование все равно демонстрирует огромный потенциал для изучения абстиненции и зависимости, утверждает Монтанер. "Они выделяют множество потенциальных терапевтических мишеней, которые могут быть использованы в будущем для проверки гипотезы "Могут ли эти вмешательства повлиять на цикл абстиненции?", - спрашивает он. "Если ответ на этот вопрос будет "Да", то последствия будут весьма значительными, потому что именно симптомы абстиненции приводят людей к повторному употреблению".
Монтанер отмечает, что было бы довольно просто проверить, предсказывает ли количество уязвимых Treg-клеток тяжесть абстиненции, и что он планирует сделать это в своем собственном предстоящем исследовании. Кроме того, добавляет он, любая исследовательская группа, у которой все еще есть образцы, полученные в ходе предыдущих исследований абстиненции, может вернуться и поискать эти клетки. "Такие вопросы мы не могли задать до этого [исследования]", - говорит он.
Между тем, Эйзенштейн предполагает, что, основываясь на результатах данного исследования, было бы целесообразно испытать препараты, блокирующие IFN-γ, на людях, употребляющих опиоиды или героин, и посмотреть, предотвращают ли они абстиненцию или смягчают ее.
Yongsheng Zhu et al. Опиоид-индуцированные хрупкие регуляторные Т-клетки способствуют абстиненции (аннотация).
Дисрегуляция иммунной системы является кардинальной особенностью опиоидной зависимости.
В данном исследовании мы охарактеризовали ландшафт иммунных клеток периферической крови пациентов с опиоидным расстройством и здоровых людей. В крови пациентов с опиоидной зависимостью наблюдалось аномальное распределение иммунных клеток, характеризующееся значительным увеличением хрупких регуляторных Т-клеток (Tregs), что положительно коррелировало с показателями абстиненции. Аналогичным образом, мыши, получавшие опиоидную терапию, также демонстрировали повышенную экспрессию Treg-производных интерферона-γ (IFN-γ). Сигнализация IFN-γ изменила синаптическую морфологию в нейронах nucleus accumbens (NAc), модулируя последующие симптомы абстиненции. Мы продемонстрировали, что опиоиды увеличивают экспрессию нейрон-деривата C-C мотив хемокина лиганда 2 (Ccl2) и нарушают целостность гематоэнцефалического барьера (BBB) через снижение регуляции астроцитов-деривата жирного кислотосвязывающего белка 7 (Fabp7), что вызвало инфильтрацию периферических Treg в NAc.
Наше исследование демонстрирует, что опиоиды стимулируют экспансию хрупких Tregs и способствуют периферическому диапедезу Treg через BBB, что приводит к IFN-γ-опосредованной синаптической нестабильности и последующему синдрому отмены.