Первые генные терапии представляют собой живые лекарства: иммунные клетки, взятые у раковых больных, сконструированные для борьбы с опухолевыми клетками.
Однако у многих пациентов эти передовые методы лечения не приводят к длительной ремиссии. Поэтому ученые из Нью-Йоркского геномного центра и Нью-Йоркского университета разработали платформу генетического скрининга для выявления генов, которые могут улучшить иммунные клетки, сделав их более стойкими и повысив их способность уничтожать опухолевые клетки.
В журнале Nature исследователи описывают открытие генных программ, которые глубоко перестраивают Т-клетки, делая их более эффективными в поиске и борьбе с раковыми клетками. Исследовательская группа под руководством Невилла Санджана, из Нью-Йоркского геномного центра, проанализировала влияние почти 12 000 различных генов в многочисленных субпопуляциях Т-клеток, полученных от человеческих доноров. Целью этого крупномасштабного генетического скрининга было выявить именно те гены, которые обеспечивают пролиферацию Т-клеток, и понять, как эти гены влияют на другие аспекты функционирования иммунных клеток, имеющие отношение к борьбе с раком.
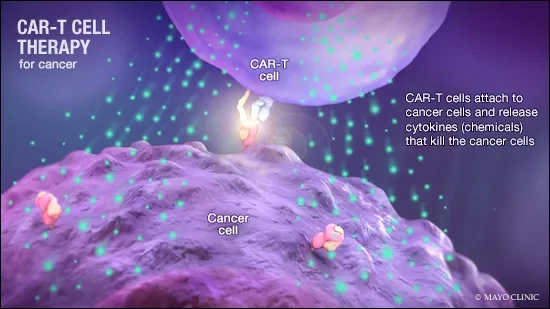
Предыдущие попытки создания Т-клеток были направлены на борьбу с конкретными типами опухолей путем тщательного отбора раковых или тканеспецифических белков (антигенов). Впервые разработанная более 30 лет назад терапия химерными антигенными рецепторами (CAR)-Т-клетками доказала свою высокую эффективность в борьбе с раковыми клетками крови, что привело к появлению множества одобренных FDA CAR-T терапий. CAR-T-клетки имеют на своей поверхности антигенные рецепторы, которые распознают специфические белки, присутствующие на раковых клетках, и уничтожают их. Некоторые пациенты избавляются от рака даже через десять лет после терапии CAR-T-клетками, поскольку Т-клетки, введенные несколькими годами ранее, продолжают выполнять свою работу. Но одна из главных задач, стоящих перед биомедицинской наукой, - понять, почему большинство раковых больных, получающих CAR-T-клетки, не достигают стойкой ремиссии.
Санджана объясняет: "До сих пор генная инженерия Т-клеток была направлена на поиск новых антигенов или новых CAR. Мы применили радикально иной подход: вместо того чтобы менять антитело, мы подумали, почему бы не попробовать добавить гены, которые превращают Т-клетки в более агрессивных борцов с раком? Эти гены-модификаторы очень хорошо сработали при раке крови, и мы считаем, что они, вероятно, сработают при использовании нескольких антигенов и при солидных опухолях".
Комбинируя гены-модификаторы, выявленные в ходе анализа, с существующими CAR, исследователи смогли создать Т-клетки, которые более эффективно уничтожали опухолевые клетки. Один конкретный ген-модификатор, рецептор лимфотоксина бета (LTBR), действует как молекулярный источник молодости: с LTBR Т-клетки размножаются, имеют большую долю молодых, более похожих на стволовые клетки клеток и сопротивляются истощению со временем. Добавление LTBR также заставило Т-клетки выделять больше цитокинов, которые жизненно важны для противоопухолевой активности Т-клеток. Цитокины играют важную роль, позволяя Т-клеткам лучше взаимодействовать с другими иммунными клетками организма и осуществлять скоординированные атаки на рак. Интересно, что LTBR обычно не экспрессируется в Т-клетках, что подчеркивает возможности геномного скрининга для поиска генов, активирующих совершенно новые клеточные программы.
"Нашей целью было взять существующие иммунотерапевтические препараты и сделать их лучше. Мы были поражены тем, что LTBR так значительно потенцирует CAR-терапию. Это важный шаг вперед на пути к разработке CAR-T клеточной терапии нового поколения", - сказал Санджана. Исследовательская группа обнаружила, что добавление LTBR перестраивает геном Т-клетки, запуская экспрессию многих других генов, которые потенцируют функцию Т-клеток. Авторы смогли быстро понять влияние LTBR и аналогичных генов-модификаторов, объединив скрининг сверхэкспрессии генов с геномикой единичных клеток.
Разработанный ими новый метод - OverCITE-seq - позволил исследователям проверить влияние различных генов-модификаторов на состояние Т-клеток, которое включает экспрессию каждого гена, белков, покрывающих поверхность клетки, и уникальных Т-клеточных рецепторов, экспрессируемых каждой клеткой (клонотип). OverCITE-seq дал исследователям подробную картину того, как каждый ген-модификатор повышает активность Т-клеток, и сделал это для всех генов, занимающих верхние строчки в рамках одного эксперимента с единичными клетками. Для LTBR это позволило получить ранние признаки изменения большого количества генов, что привело исследователей к дальнейшему выявлению хорошо изученного модулятора экспрессии генов под названием NF-kB, приводящего в действие многие из этих изменений. Такое глубокое перепрограммирование под действием LTBR наблюдалось и в так называемых нетрадиционных Т-клетках, которые присутствуют в меньшем количестве, чем обычные Т-клетки, но могут поражать более разнообразные опухоли.
"Самым захватывающим аспектом является демонстрация того, что LTBR и другие высоко ранжированные гены улучшили антиген-специфические ответы химерных антигенных рецепторов Т-клеток. Если это подтвердится in vitro и в клинических испытаниях, это может иметь серьезные последствия для будущих CAR-T клеточных терапий как лимфоидных злокачественных опухолей, так и других видов рака", - рассказал Санджана. Группа также объединила несколько лучших генетических модификаторов с CAR, аналогичными двум существующим препаратам для лечения рака крови, одобренным FDA: тисагенлейцелом (Kymriah) и аксикабтаген цилолейцелом (Yescarta). Практически все испытанные модификаторы усилили ответ CAR-T, включая LTBR. Поскольку Т-клетки больных раком обычно находятся в плохом состоянии по сравнению с Т-клетками здоровых доноров, исследователи хотели также проверить способность LTBR омолаживать Т-клетки больных раком. Они добавили LTBR вместе с CAR к дисфункциональным Т-клеткам пациентов с диффузной крупноклеточной лимфомой, раком крови, и обнаружили аналогичное усиление функции Т-клеток, что позволяет предположить, что технология может работать в качестве оптимизированной терапии в клинике.
Эндрю Сьюэлл, эксперт по Т-клеткам и иммунотерапии из Медицинской школы Кардиффского университета, который не принимал участия в исследовании, отметил: "Скрининг генов функций в Т-клетках имеет большой потенциал для выявления того, как сделать иммунотерапию более успешной - особенно в солидных раковых опухолях, где существующие методы терапии CAR T-клеток работают плохо". Исследовательская группа также показала, что Т-клетки, усиленные генами-модификаторами, лучше уничтожают не только лейкемию, но и клетки рака поджелудочной железы. Эти результаты обнадеживают не только в плане разработки более широкой панели усовершенствованных CAR-T терапий для лечения рака крови, но и в плане ключевой роли, которую они могут сыграть в борьбе с солидными опухолями - области, в которой создание эффективной CAR-T иммунотерапии было более сложной задачей.
Лаборатория Санджана сфокусирована на разработке новых технологий редактирования генов и функциональной геномики, чтобы снизить высокий уровень неудач существующих иммунотерапий и создать терапию следующего поколения. Поскольку новые гены-модификаторы, такие как LTBR, могут работать рука об руку с уже утвержденными CAR-T терапиями, это исследование имеет явный потенциал для перехода от лаборатории к клинике и улучшения результатов лечения онкологических больных во всем мире.
Mateusz Legut et al. Геномный скрининг синтетических драйверов пролиферации Т-клеток (аннотация).
Инженерия аутологичных Т-клеток пациента для адаптивной клеточной терапии произвела революцию в лечении нескольких видов рака. Однако для увеличения числа ответов и излечений необходимы дальнейшие усовершенствования. Скрининги потери функции на основе CRISPR были ограничены негативными регуляторами функций Т-клеток и вызывают опасения по поводу безопасности из-за постоянной модификации генома. В данном исследовании мы выявляем положительные регуляторы функций Т-клеток путем сверхэкспрессии около 12 000 штрих-кодированных human open reading frames (ORFs). Гены, занявшие первые места, увеличивали пролиферацию и активацию первичных человеческих CD4+ и CD8+ Т-клеток и секрецию ими ключевых цитокинов, таких как интерлейкин-2 и интерферон-γ. Кроме того, мы разработали метод геномики единичных клеток OverCITE-seq для высокопроизводительной количественной оценки транскриптома и поверхностных антигенов в ORF-инженерных Т-клетках.
ORF, занявшая первое место - рецептор лимфотоксина-β (LTBR) - обычно экспрессируется в миелоидных клетках, но отсутствует в лимфоцитах. При сверхэкспрессии в Т-клетках LTBR вызывает глубокое транскрипционное и эпигеномное ремоделирование, что приводит к повышению эффекторных функций Т-клеток и устойчивости к истощению в условиях хронической стимуляции за счет конститутивной активации канонического пути NF-κB. LTBR и другие высокоранжированные гены улучшили антиген-специфические ответы химерных Т-клеток с антигенными рецепторами и γδ Т-клеток, что подчеркивает их потенциал для будущих терапий рака.
Наши результаты дают несколько стратегий для улучшения терапии Т-клетками нового поколения путем индукции синтетических клеточных программ.