Недавнее исследование демонстрирует многообещающие результаты анализа крови, который может быть использован для выявления изменений в мозге при болезни Альцгеймера (БА) до появления симптомов, что может привести к применению профилактических методов лечения.
В работе, опубликованной в журнале Alzheimer's & Dementia: Journal of the Alzheimer's Association, исследователи отмечают, что выявление патологии, вызывающей БА и сосудистые факторы когнитивных нарушений и деменции (VCID), ограничивается оценкой когнитивных функций и нейровизуализацией, такой как МРТ и ПЭТ-сканирование. Благодаря последним технологическим достижениям теперь доступен анализ крови на биомаркеры.
Закари Уинде, возглавил это исследование, в котором использовался обширный банк образцов аутопсий Центра исследований болезни Альцгеймера Университета Кентукки. Для этого исследования ученые отобрали образцы крови, хранившиеся в банке в течение двух лет после смерти. Затем они проверили образцы крови 90 участников на наличие различных белков с целью выявления биомаркеров, которые могли бы предсказать изменения в мозге, способствовавшие развитию деменции.
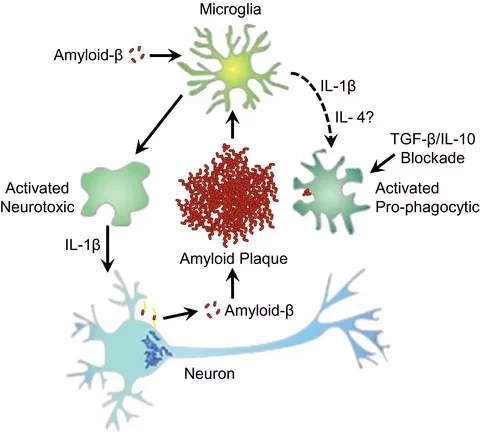
Они считают, что их результаты поддерживают продолжение изучения биомаркеров крови в качестве инструмента клинического скрининга БА и VCID. "Это исследование предоставляет доказательства того, что анализ крови может быть использован для оценки наличия изменений при БА и повреждений кровеносных сосудов в мозге. Мы определили белки в крови, которые указывают на изменения в мозге, известные как причина деменции. Более высокий уровень pTau181 и более низкий уровень бета-амилоида в крови указывают на наличие амилоидных бляшек при БА", - отметил Уиндер. "Белковые маркеры воспаления в крови также были ассоциированы с большим количеством амилоидных бляшек в мозге и повреждением кровеносных сосудов в мозге".
Уиндер и другие члены исследовательской группы согласны с тем, что обнаружение биомаркеров, позволяющих врачам диагностировать и наблюдать за пациентами, является важнейшим шагом на пути к выявлению пациентов, находящихся в группе риска, но еще не имеющих симптомов, которые могут быть более восприимчивы к потенциальным терапевтическим средствам. "Образцы крови можно легко взять даже при посещении врача первичного звена. Разработка анализа крови устранит необходимость в дорогостоящем специализированном ПЭТ-сканировании или инвазивных, неудобных спинномозговых пункциях", - отмечает Уиндер.
Благодаря исследованной когорте ученые обнаружили, что существуют смешанные причины деменции и что белки в крови коррелируют с изменениями в мозге. Они считают, что эти открытия дают дополнительные доказательства того, что биомаркеры крови имеют большой потенциал для диагностики БА и других причин деменции. До последних лет единственным способ точно понять, страдал ли пациент БА была аутопсия. Достижения в исследовании биомаркеров позволяют ученым наблюдать за изменениями в мозге еще при жизни человека, следить за развитием болезни и проверять эффективность потенциальных методов лечения.
Zachary Winder et al. Изучение связи между биомаркерами крови и посмертной невропатологией человека в когорте аутопсий Центра исследования болезни Альцгеймера Университета Кентукки (аннотация).
Введение
В клинических условиях выявление патологии, вызывающей болезнь Альцгеймера (БА) и сосудистый вклад в когнитивные нарушения и деменцию (VCID), ограничивается магнитно-резонансной томографией и позитронно-эмиссионной томографией, которые являются дорогостоящими и малодоступными. В данном исследовании мы оцениваем ангиогенные, воспалительные и связанные с БА биомаркеры плазмы крови, чтобы определить их связь с посмертной нейропатологией человека.
Метод
Образцы плазмы анализировались с помощью цифрового иммуноферментного анализа, а патологоанатомическая оценка проводилась невропатологами Исследовательского центра болезни Альцгеймера Университета Кентукки. Связь плазменных маркеров с невропатологией оценивалась с помощью пропорциональных шансов и логистических регрессий с поправкой на возраст.
Результаты
У включенных пациентов (N = 90) увеличение соотношения тау/амилоид бета (Aβ)42, глиального фибриллярного кислого белка (GFAP), фактора роста эндотелия сосудов A (VEGF-A) и плацентарного фактора роста (PlGF) было положительно связано с более высоким уровнем нейропатологических изменений при БА, в то время как увеличение соотношения Aβ42/Aβ40 было связано отрицательно. Более высокие уровни PlGF, VEGF-A и интерлейкина 6 были обратно связаны с хроническим цереброваскулярным заболеванием, в то время как соотношение Aβ42/Aβ40 было связано положительно.
Обсуждение
Наши результаты подтверждают необходимость дальнейшего изучения биомаркеров плазмы крови в качестве инструмента клинического скрининга патологии БА и VCID.