Будучи одним из первых типов клеток на месте повреждения кожных покровов, нейтрофильные гранулоциты в течение нескольких часов рекрутируются из кровотока в очаг инфекции для уничтожения потенциальных микробных захватчиков.
"Нейтрофилы очень эффективно охотятся на бактерии и убивают их", - говорит Тим Леммерманн, руководитель группы иммунобиологии и эпигенетики и соавтор исследования, опубликованного в Science. Нейтрофилы очень многочисленные клетки, составляющие около 50-70% лейкоцитов. По оценкам, ежедневно в стволовых клетках костного мозга взрослого человека вырабатывается 100 миллиардов нейтрофилов.
"Эти клетки патрулируют почти все уголки нашего тела, и они очень эффективны в обнаружении всего потенциально опасного в нашем организме. Как только отдельные нейтрофилы обнаруживают поврежденные клетки или вторгшиеся микробы в ткани, они начинают выделять аттрактивные сигналы, которые воздействуют через рецепторы клеточной поверхности на соседние нейтрофилы, чтобы привлечь все больше и больше клеток". Используя эту межклеточную коммуникацию, нейтрофилы могут действовать вместе как клеточный коллектив и эффективно координировать очистку от патогенов.
Однако эта форма эффективного воспаления может также привести к обширному повреждению тканей. Если интенсивность или продолжительность реакции нарушается, те же механизмы, которые служат для уничтожения вторгающихся патогенов, могут также вызвать сопутствующее повреждение здоровых тканей. Например, вещества, которые нейтрофилы выделяют для уничтожения вторгшихся патогенов, также разрушают сеть белков и сахаров, которая обеспечивает структурную основу тканей.
"В этом исследовании мы начали с вопроса о том, что останавливает реакцию скопления нейтрофилов во избежании их неконтролируемого накопление и предотвращении чрезмерного воспаления, которое может способствовать развитию дегенеративных заболеваний, таких как рак, диабет и аутоиммунные заболевания", - говорит Леммерманн. В предыдущих исследованиях он и его сотрудники уже обнаружили молекулярные механизмы, инициирующие коллективное роеподобное поведение. Однако процессы, которые приводят к завершению этой реакции, оставались неизвестными.
"Роение" нейтрофилов все еще является относительно новой темой в области исследований воспаления и инфекции, и лежащие в его основе механизмы только начинают изучаться. Новейшее исследование, проведенное в лаборатории Леммерманна, показывает, как нейтрофилы самостоятельно ограничивают свою роевую активность в инфицированных бактериями тканях и таким образом балансируют между фазами поиска и уничтожения патогенов.
Используя специализированную микроскопию для визуализации динамики иммунных клеток в реальном времени в тканях живых мышей, исследователи демонстрируют, что роящиеся нейтрофилы становятся нечувствительными к собственным секретируемым сигналам, которые изначально инициировали образование роя. "Мы выявили молекулярный разрыв в нейтрофилах, который останавливает их движение, как только они чувствуют высокую концентрацию аттрактантов при больших скоплениях нейтрофилов", - рассказывает Леммерманн.
"Это было удивительно, поскольку преобладающее мнение утверждает, что внешние сигналы, высвобождаемые из тканевой среды, имеют решающее значение для остановки активности нейтрофилов в фазе разрешения воспаления", - комментирует Вольфганг Кастенмюллер, научный сотрудник Исследовательской группы Макса Планка по системной иммунологии в Университете Вюрцбурга.
В свете обнаруженной системы "старт-стоп" в нейтрофилах исследователи пересмотрели существующие взгляды на то, как нейтрофилы ориентируются в тканях для эффективного уничтожения бактерий. В экспериментах с нейтрофилами, лишенными механизма остановки, команда наблюдала чрезмерное скопление иммунных клеток и сканирование ими больших участков инфицированной бактериями ткани, что контрастировало с поведением клеток с функционирующей системой старт-стоп.
Однако это усиленное роение и сканирование не сделало эти клетки лучшими уничтожителями патогенов. "Поразительно, но мы сделали противоположный вывод. Нет ничего хорошего в том, что нейтрофилы двигаются слишком быстро и бегают как сумасшедшие. Напротив, им выгоднее остановиться и вместе поживиться бактериями - это более эффективно для сдерживания роста бактерий в тканях", - объясняет Леммерманн.
Благодаря этим результатам исследователи прокладывают путь к лучшему пониманию биологии нейтрофилов, которая необходима для иммунной защиты хозяина от бактерий и может стать основой для терапевтических подходов в будущем. Более того, роевое поведение и лежащие в его основе механизмы могут также помочь в изучении других категорий коллективного поведения и самоорганизации клеток.
Korbinian Kienle et al. Нейтрофилы самостоятельно ограничивают свое скопление для сдерживания роста бактерий in vivo (аннотация).
Коллективное поведение клеток и насекомых часто основывается на процессах самоорганизации. Высвобождая привлекающие сигналы, несколько особей могут инициировать скопление и агрегацию целой популяции. Нейтрофилы, ключевые участники врожденного иммунного ответа, в большом количестве проникают в воспаленные и инфицированные ткани. Эти клетки используют такую положительную обратную связь для поиска и уничтожения бактерий в тканях. Выделяя аттрактанты, которые действуют через экспрессированные на поверхности клеток рецепторы, связанные с белками G (GPCRs) на соседних клетках, нейтрофилы используют эту форму межклеточной коммуникации и координируют свою охоту на патогены в виде роя. Как прерывается этот роевой ответ, чтобы избежать неконтролируемого скопления нейтрофилов и предотвратить чрезмерное воспаление, в настоящее время неизвестно.
Сигналы остановки роения нейтрофилов в тканях млекопитающих еще не идентифицированы. Они могут исходить от клеток окружающей воспалительной среды или от самих нейтрофилов. Мы предположили, что аттрактанты, выделяемые нейтрофилами, могут стать высококонцентрированными в местах скопления этих клеток в большом количестве. Хорошо известно, что высокие концентрации хемоаттрактантов могут ослаблять клеточный ответ в результате процесса, называемого десенситизацией GPCR. Мы выдвинули гипотезу о самоограничивающем механизме роения: локальное накопление тех же аттрактантов, экспрессируемых нейтрофилами, которые усиливают роение на ранних стадиях, вызывает десенситизацию соответствующих GPCR на более поздних стадиях кластеризации нейтрофилов. Это побудило нас исследовать роль десенситизации GPCR в тканевой навигации нейтрофилов и защите хозяина.
Результаты
Мы создали линии мышей, нейтрофилы которых были лишены киназ GPCR (GRK), критических ферментов, опосредующих процесс десенситизации GPCR. Из четырех протестированных изоформ GRK эксперименты in vitro выявили GRK2 как киназу, необходимую для десенситизации GPCR, активированных аттрактантами, высвобождаемыми роем (LTB4 и CXCL2). Когда нейтрофилы чувствуют высокие концентрации аттрактантов роя in vitro, GRK2 десенсибилизирует соответствующие рецепторы, вызывая остановку миграции. Двухфотонная интравитальная визуализация поврежденной кожи и инфицированных лимфатических узлов мышей показала, что GRK2 и десенситизация GPCR играют критическую роль во время роения нейтрофилов в физиологических тканях. В местах скопления роящихся нейтрофилов и самогенерирования локальных полей с высокой концентрацией аттрактанта роя, десенситизация GPCR имела решающее значение для остановки миграции нейтрофилов.
Устойчивые к десенситизации нейтрофилы двигались быстрее и исследовали большие участки ткани лимфатического узла, инфицированного бактерией Pseudomonas aeruginosa. Такое поведение говорит о более эффективном захвате бактерий во всем инфицированном органе. Удивительно, но у мышей с GRK2-дефицитными нейтрофилами бактериальный клиренс скорее ухудшался, чем улучшался. Этот результат не может быть объяснен изменением антибактериальных эффекторных функций. Анализы in vitro для детального анализа поведения роя и роста бактерий показали, что десенситизация GPCR к аттрактантам роя необходима, чтобы вызвать остановку нейтрофилов для оптимального фагоцитоза и удержания бактерий в скоплениях роя.
Заключение
Мы описали внутренне присущий клеткам механизм остановки самоорганизации коллективов нейтрофилов в инфицированных тканях, который основан на восприятии локального накопления тех же выделяемых клетками аттрактантов, которые усиливают роение на ранних стадиях. Десенситизация GPCR действует как механизм контроля с отрицательной обратной связью для остановки миграции нейтрофилов в роевых агрегатах. Этот механизм навигации позволяет нейтрофилам самостоятельно ограничивать свою динамику в формирующихся роях и обеспечивает оптимальную элиминацию бактерий.
Десенситизация к самостоятельно продуцируемому сигналу активации как принцип самоорганизации важна для иммунной защиты хозяина от бактерий и, вероятно, лежит в основе других категорий коллективного поведения клеток и насекомых.
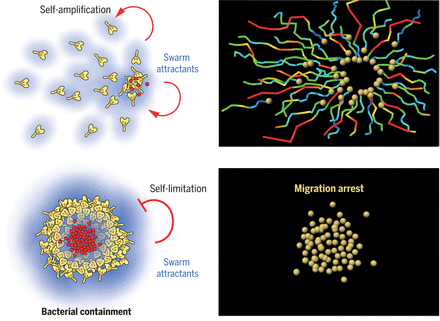
Самоорганизация роев нейтрофилов.
Вверху: Роящиеся нейтрофилы самостоятельно усиливают свое высоко хемотаксическое привлечение к местам повреждения тканей или бактериальной инвазии, выделяя аттрактанты, которые действуют на соседние нейтрофилы. Нейтрофилы показаны в виде сфер с миграционными путями (справа). Внизу: Местное накопление тех же аттрактантов, выделяемых клетками, останавливает нейтрофилы, когда они аккумулируются и образуют скопления - процесс, важный для сдерживания бактерий в инфицированных тканях.