Новые сведения о биологии опухолей легких и потенциальных мишенях для лекарственных препаратов получены в результате исследования, объединяющего геномику и протеомику.
Рак легких остается основной причиной смерти от рака в США и во всем мире. Пациенты с подтипом, называемым аденокарциномой легкого (LUAD), выиграли от разработки новых целевых лекарств, но поиск эффективных новых методов лечения другого подтипа, называемого плоскоклеточной карциномой легкого (LSCC), в основном не увенчался успехом.
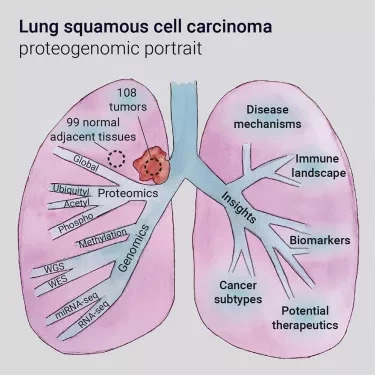
Чтобы узнать больше о биологических основах LSCC, группа под руководством исследователей из Института Броуда Массачусетского технологического института разработала самую большую и наиболее полную на сегодняшний день молекулярную карту LSCC. Их усилия, представленные в журнале Cell, объединяют протеомные, транскриптомные и геномные данные в подробный "протеогеномный" взгляд на LSCC. Анализ этих данных выявил потенциальные новые мишени для лекарственных препаратов, пути иммунной регуляции, которые могут помочь раку уклониться от иммунотерапии, и даже новый молекулярный подтип LSCC. Данные исследования доступны на портале CPTAC (https://proteomics.cancer.gov/data-portal).
"Пациенты с плоскоклеточным раком легких имеют очень ограниченные терапевтические возможности, и даже скромный успех в понимании этого заболевания может изменить жизнь людей к лучшему",
- говорит в интервью Science Daily Шанкха Сатпати, соавтор исследования. "Мы надеемся, что исследовательское сообщество, от фундаментальных ученых до практикующих онкологов, воспользуется этим новым ресурсом для проверки гипотез, стимулирования дальнейших исследований и открытия новых основанных на данных путей для разработки клинических испытаний, которые в конечном итоге могут принести пользу пациентам".
В своем исследовании команда проанализировала ДНК, РНК, белки и посттрансляционные модификации белков (PTMs, т.е. фосфорилирование, ацетилирование и убиквитилирование) 108 опухолей до лечения и сравнила их с нормальными тканями. Среди возможностей, которые они увидели для разработки новых методов лечения LSCC, исследователи определили ген NSD3 как возможную мишень для опухолей, содержащих дополнительные копии FGFR1, другого гена, который часто дублируется или усиливается при LSCC.
Ранее предпринимались безуспешные попытки воздействовать непосредственно на FGFR1. Полученные группой протеогеномные данные позволяют предположить, что NSD3 может быть критическим фактором роста и выживания опухоли, что делает его потенциальной терапевтической мишенью. Они также отметили подгруппу пациентов, в опухолях которых наблюдалась низкая экспрессия p63, но высокая экспрессия сурвивина, белка, регулирующего клеточную пролиферацию и клеточную смерть и являющегося мишенью клинических испытаний при других типах опухолей. Кроме того, данные группы показали, что опухоли, вызванные сверхэкспрессией транскрипционного фактора SOX2, могут быть восприимчивы к лечению, направленному против модификаторов хроматина, таких как LSD1 и EZH2. Сам SOX2 обычно считается "не поддающейся лечению" мишенью; наблюдения команды указывают на возможность разработки терапевтического обходного пути.
"Протеомные и PTM данные помогают нам увидеть функциональные эффекты генома", - объясняет Майкл Джиллетт, соавтор исследования. Понимание того, на какие уровни белков влияют изменения числа копий и как мутации влияют на экспрессию белков и активность путей, позволяет глубже понять биологию рака. Часто эти данные указывают на неизученные варианты терапии или на конкретные субпопуляции, которые могут получить пользу от определенных методов лечения", - добавил он. "Это особенно важно при таком заболевании, как LSCC, где так много клинических испытаний потерпели неудачу".
Несмотря на то, что иммунотерапия представляет собой самый большой прогресс в лечении LSCC за последние десятилетия, результаты лечения пациентов отстают от результатов лечения LUAD; лишь у меньшинства пациентов с LSCC наблюдаются долгосрочные результаты. На основе своих протеогеномных данных исследователи представили подробную картину иммунного ландшафта LSCC, выделив несколько путей иммунной регуляции, которые могут служить мишенями. В частности, их анализ выделил подгруппу опухолей, в которых присутствуют маркеры, связанные с ответом на ингибиторы контрольных точек иммунитета (такие как блокаторы PD-1/PD-L1), а также с уклонением от иммунитета, что дает некоторые подсказки относительно того, почему результаты иммунотерапии у пациентов с LSCC настолько различны.
"Более глубокое понимание иммунного ландшафта опухолей LSCC может в конечном итоге привести к более эффективным иммунотерапиям и маркерам для стратификации пациентов",
- говорит Чжан, профессор отделения молекулярной генетики и генетики человека в Бэйлоре.
Убиквитилирование - это процесс, в ходе которого клетка связывает белки с другим небольшим белком, называемым убиквитином (или его биохимическими родственниками), чтобы направить их на деструкцию. Хотя этот процесс важен для нормального функционирования, при дисрегуляции он может способствовать развитию или привести к болезни. Ранее коллектив разработал технологию UbiFast, которая позволяет проводить глубокий и высокопроизводительный анализ убиквитилирования в образцах тканей пациентов. Примененный к LSCC, UbiFast выявил сложную регуляцию метаболических путей, таких как гликолиз и окислительный стресс, обусловленную молекулярным взаимодействием на основе убиквитилирования (или убиквитиноподобных модификаций) и двух других форм модификации белков - фосфорилирования (которое изменяет ферментативную или каталитическую активность белка) и ацетилирования (которое может влиять на структуру, активность, локализацию и стабильность белка).
Предыдущие работы выявили четыре молекулярных подтипа LSCC с помощью геномики, соответствующих различным типам клеток и процессам. С помощью протеомной перспективы исследовательская группа не только получила более глубокое понимание иммунных, метаболических и пролиферативных сигналов, связанных с этими подтипами, но и обнаружила новый подтип эпителиально-мезенхимального транзита. Клетки этого нового типа, отметили они, могут иметь больший потенциал для метастазирования, а также отличаются активными молекулярными путями, управляемыми киназами, на которые можно воздействовать терапевтически.
"Это замечательно, потому что в опухолях LSCC обычно отсутствуют киназные изменения, присутствующие в LUAD, которые послужили основой для разработки широкого спектра терапевтических ингибиторов", - отметила Ана Роблес, директор программы в Отделе исследований клинической протеомики рака NCI.
Участники исследования выполняли свою работу под эгидой CPTAC - спонсируемого NCI междисциплинарного/многоинституционального проекта, направленного на ускорение понимания молекулярных основ рака путем применения крупномасштабного протеогеномного анализа. Данная работа основана на предыдущих исследованиях CPTAC и Международного консорциума по протеогеномике рака, посвященных LUAD. Все наборы данных, созданные CPTAC, доступны для исследовательского сообщества в качестве уникального общественного ресурса, который обеспечивает исключительную основу для проведения дальнейших исследований и поддержки разработки терапевтических методов лечения LSCC и других видов рака.
"Такие исследования, как наше и другие, все больше демонстрируют важность проведения мультиомических, интегративных анализов опухолей для более детального и глубокого понимания рака", - считает Стивен Карр, старший директор отдела протеомики в Броуд. "Эти исследования уже выявили новые, ранее не распознанные мишени для терапевтического воздействия".
Shankha Satpathy et al. Протеогеномный портрет плоскоклеточной карциномы легких (аннотация).
Плоскоклеточная карцинома легких (LSCC) остается одной из ведущих причин смерти от рака, при этом терапевтических возможностей мало. Мы охарактеризовали протеогеномный ландшафт LSCC, обеспечив более глубокое раскрытие биологии LSCC с потенциальными терапевтическими последствиями. Мы определили NSD3 как альтернативный драйвер в FGFR1-амплифицированных опухолях и опухолях с низким уровнем p63, сверхэкспрессирующих терапевтическую мишень сурвивин. Считается, что SOX2 не поддается лечению, но наш анализ дает основания для изучения модификаторов хроматина, таких как LSD1 и EZH2, для воздействия на опухоли, экспрессирующие SOX2.
Наши данные подтверждают комплексную регуляцию метаболических путей путем перекрестного взаимодействия посттрансляционных модификаций, включая убиквитилирование. Многочисленные протеогеномные наблюдения, связанные с иммунитетом, указывают на направления дальнейших исследований. Протеогеномное изучение мутаций CDKN2A требует более тонкой оценки экспрессии и фосфорилирования белка RB1, прежде чем признавать ингибирование CDK4/6 безуспешным. Наконец, триангуляция между LSCC, LUAD и HNSCC выявила как уникальные, так и общие терапевтические уязвимости.
Эти наблюдения и данные протеогеномики могут послужить руководством для исследований в области биологии и лечения LSCC.