Исследователи сделали неожиданное открытие о том, как поддерживаются иммунные "дозорные" клетки, что может иметь последствия для разрабатываемых препаратов для лечения рака.
Исследователи, работа которых опубликована в журнале Science Immunology, изучили влияние удаления специфических белков в иммунных клетках, которые отвечают за контроль способности клеток заглушать или выключать гены. Они с удивлением обнаружили, что удаление одного из компонентов механизма повлияло на одну популяцию "дозорных" иммунных клеток, в результате чего они полностью исчезли из кожи и легких. Это говорит о том, что лекарственные препараты, подавляющие этот компонент для лечения таких заболеваний, как рак, могут иметь непредвиденные последствия для иммунной системы. Исследовательская группа изучала роль поликомб репрессивного комплекса 2 (PRC2) в иммунных клетках переднего края.
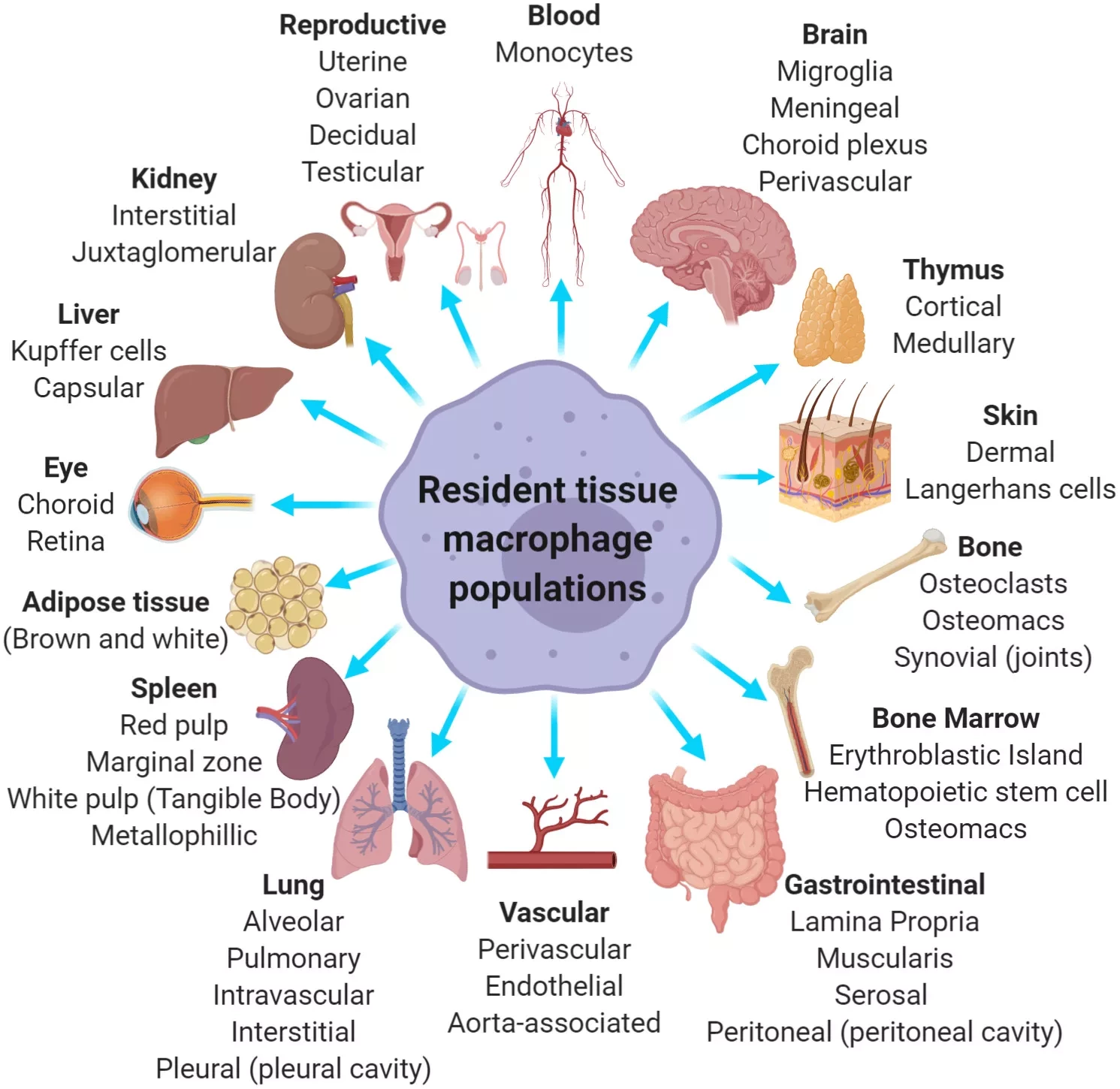
Соавтор исследования Майкл Шопен отметил, что PRC2 отвечает за "выключение" генов, в том числе в иммунных клетках, что необходимо для поддержания их численности и нормального функционирования. "Наша лаборатория исследует регуляцию генов, или молекулярные процессы внутри клеток, которые контролируют, как и когда используются гены, закодированные в нашей ДНК", - сказал он. "Мы изучили функцию PRC2 в двух популяциях иммунных клеток, которые образуют первую линию защиты от инфекции. Эти клетки обеспечивают критический иммунный барьер для внешней среды, защищая кожу и легкие от вторжения микробов."
Исследовательская группа удалила два компонента комплекса, фермент EZH2 и структурный белок Suz12, чтобы посмотреть, как это повлияет на развитие, популяции и функции иммунных клеток.
Удаление EZH2 не повлияло на биологию и функции ни одной из популяций клеток - клетки по-прежнему были способны эффективно реагировать на вирусную инфекцию. "Мы с удивлением обнаружили, что удаление EZH2 практически не повлияло на иммунные клетки", - говорит Шопен. Напротив, при удалении Suz12 определенные популяции макрофагов, например, те, которые обитают в нашей коже и легких, полностью исчезали. "Эти макрофаги, обитающие в тканях, отвечают за обнаружение и избавление организма от различных проникающих бактерий и зараженных вирусами клеток, а также за оповещение организма о том, что он подвергается атаке, путем стимулирования выработки воспалительных сигналов", - рассказывает Шопен.
"Тканевые макрофаги обладают уникальным свойством - они способны самостоятельно поддерживать свою численность на протяжении всей взрослой жизни. Наше исследование указывает на ключевую роль Suz12 и PRC2 в управлении этой регуляторной программой этих иммунных клеток". Соавтор статьи Стивен Натт отмечает, что важно понять потенциальные последствия применения лекарственных препаратов, воздействующих на белки, которые выключают гены. "PRC2 был задействован во многих видах рака, например, в лимфоме. Во всем мире ведется большая работа по разработке лекарств, направленных на компоненты этого комплекса, для лечения рака". Он сказал, что по крайней мере один препарат, уже одобренный для лечения редкого вида саркомы, ингибирует компоненты комплекса.
"Нам необходимо более тщательно изучить, могут ли препараты, подавляющие функции EZH2 и Suz12, иметь нежелательные последствия для иммунной системы", - сказал он. С другой стороны, говорит Натт, важно также понять, какие избыточные функции существуют, которые могут помешать лекарствам оказать желаемый эффект. "В настоящее время считается, что ингибирование EZH2 приведет к ослаблению иммунного ответа, например, если вы хотите лечить иммунные или воспалительные заболевания", - говорит он. "Наше исследование показывает, что, по крайней мере, с этими специфическими иммунными клетками первой линии, которые активны на ранней стадии инфекции и запускают другие элементы иммунной системы, это маловероятно".
Натт сообщил, что данное исследование является частью более широкого внимания коллектива к регуляции генов на молекулярном уровне. "Нормальное функционирование клеток нашего организма зависит от способности каждой клетки использовать соответствующую комбинацию генов из десятков тысяч генов, закодированных в нашей ДНК, в нужном месте и в нужное время", - сказал он.
"Молекулярный контроль, который препятствует работе генов, необходим для жизни".
Yifan Zhan et al. Дифференциальные требования к комплексу репрессоров Polycomb 2 в гомеостазе дендритных клеток и миелоидных клеток, обитающих в тканях (аннотация).
Репрессивный комплекс Polycomb 2 (PRC2) отвечает за триметилирование гистона H3 на лизине-27 (H3K27me3), эпигенетическую модификацию, связанную с транскрипционной репрессией. Активность PRC2 нарушена при некоторых видах рака, но его функция в развитии миелоидных клеток неизвестна. Используя мышей с миелоид-специфической генетической делецией основных белков PRC2, Zhan и др. продемонстрировали избирательное требование к активности PRC2 в тканевых макрофагах, но не в дендритных клетках (ДК).
В то время как активность метилтрансферазы EZH2 была в целом незаменима для гомеостаза миелоидных клеток, активность PRC2 была необходима для поддержания самообновления альвеолярных макрофагов путем регуляции экспрессии генов клеточного цикла и репликации ДНК. Эти результаты демонстрируют дихотомию зависимости миелоидных клеток от PRC2, подчеркивая различия в эпигенетических механизмах, регулирующих гомеостаз ДК и макрофагов.
ДК и макрофаги находятся на переднем крае иммунного ответа, изменяя свои транскрипционные программы в ответ на тканевую среду или иммунологический вызов. Посттрансляционные модификации гистонов, такие как триметилирование лизина-27 гистона H3 (H3K27me3) репрессивным комплексом PRC2, тесно связаны с эпигенетической регуляцией экспрессии генов.
Чтобы выяснить, участвует ли H3K27me3 в создании или функционировании системы мононуклеарных фагоцитов, мы выборочно удалили основные компоненты PRC2, EZH2 или SUZ12, в CD11c-экспрессирующих миелоидных клетках. Неожиданно оказалось, что дефицит EZH2 не препятствовал депонированию и поддержанию H3K27me3 в ДК и не нарушал гомеостаз ДК/макрофагов. Напротив, дефицит SUZ12 заметно снижал способность ДК и макрофагов поддерживать H3K27me3.
А бляция SUZ12 вызвала быструю потерю сети альвеолярных макрофагов и клеток Лангерганса как в стабильном состоянии, так и в условиях воспаления, поскольку эти клетки больше не могли пролиферировать, чтобы способствовать их самообновлению. Несмотря на снижение уровня H3K27me3, абляция SUZ12 не повлияла на развитие и функцию ДК, что говорит о том, что PRC2-опосредованная репрессия генов была необязательна для гомеостаза ДК.
Таким образом, роль SUZ12 подчеркивает принципиально разные гомеостатические механизмы, используемые тканевыми резидентными миелоидными клетками и ДК.