Ученые показали, как опухолевые клетки уклоняются от иммунотерапии, создавая уникальные, временные структуры "клетка в клетке", в которых внутренние клетки остаются в целости и сохранности и могут вернуться в отдельные опухолевые клетки.
Эти результаты, опубликованные вчера в журнале eLife, представляют собой новую теорию того, как опухолевые клетки избегают уничтожения иммунной системой. Они также могут помочь в разработке методов лечения, сочетающих иммунотерапию и своевременное ингибирование соответствующих сигнальных путей в опухолевых клетках.
"Иммунотерапия рака использует иммунную систему организма для борьбы с раком. Несмотря на поразительный успех иммунотерапии, у большинства пациентов, получающих ее, опухоли уменьшаются в размерах лишь на время, а затем возвращаются, и эти рецидивные опухоли, скорее всего, будут устойчивы к лечению иммунотерапией", - говорит первый автор статьи Амит Гутвиллиг, старший научный сотрудник Университета Тель-Авива.
Чтобы определить, как рецидивируют опухоли после иммунотерапии, Гутвиллиг и его коллеги начали со сравнения генетических последовательностей полных геномов в первичных и рецидивных опухолях одного и того же пациента. Их анализ показал, что рецидивные опухоли не претерпевают значительных изменений после иммунотерапии. Затем группа исследовала этот процесс при раке молочной железы и меланоме, используя мышиные модели, в которых рецидивировали опухоли, устойчивые к иммунотерапии. Мышам вводили клетки из леченных опухолей и позволяли этим клеткам достичь ощутимого размера. Команда обнаружила, что клетки были одинаково восприимчивы к тому же подходу иммунотерапии, что и родительская опухоль, хотя рецидив наступал быстрее.
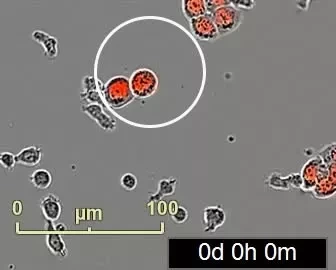
Чтобы лучше охарактеризовать опухолевые клетки, выжившие в организме мышей после иммунотерапии, исследователи выделили и изучили живые опухолевые клетки. Они обнаружили, что большинство клеток реагировало на присутствие Т-клеток путем организации во временные образования. Они состояли из скоплений нескольких ядер опухолевых клеток, которые были окружены единой многослойной мембраной и сеткой кортикальных актиновых нитей. Внутренняя клетка образования была плотной и казалась уплотненной внутри другой клетки.
Чтобы показать, что этот результат не был связан с изоляцией клеток меланомы, команда также проанализировала опухоли с флуоресцентно меченными клеточными ядрами и мембранами. Они обнаружили, что образование "клетка в клетке" было более распространено в опухолях, подвергшихся иммунотерапии, особенно в участках, связанных с гибелью опухолевых клеток. Дальнейший анализ показал, что примерно половина опухолевых клеток, переживших иммунотерапию, располагались по типу "клетка в клетке". Со временем эти клетки вернулись к одноклеточному состоянию со структурными особенностями, сходными с таковыми у родительской линии клеток.
Далее команда проверила, происходит ли это явление в раковых опухолях человека. Для этого они инкубировали линии опухолевых клеток с предварительно активированными Т-клетками от здоровых доноров. Они обнаружили, что подавляющее большинство опухолевых клеток молочной железы, толстой кишки и меланомы, выживших после уничтожения Т-клетками, организовались в структуры "клетка в клетке". Трехдневное наблюдение за Т-клетками, взаимодействующими с опухолевыми клетками, показало, что эти структуры были динамичными, отдельные опухолевые клетки постоянно формировались и диссеминировали из структуры.
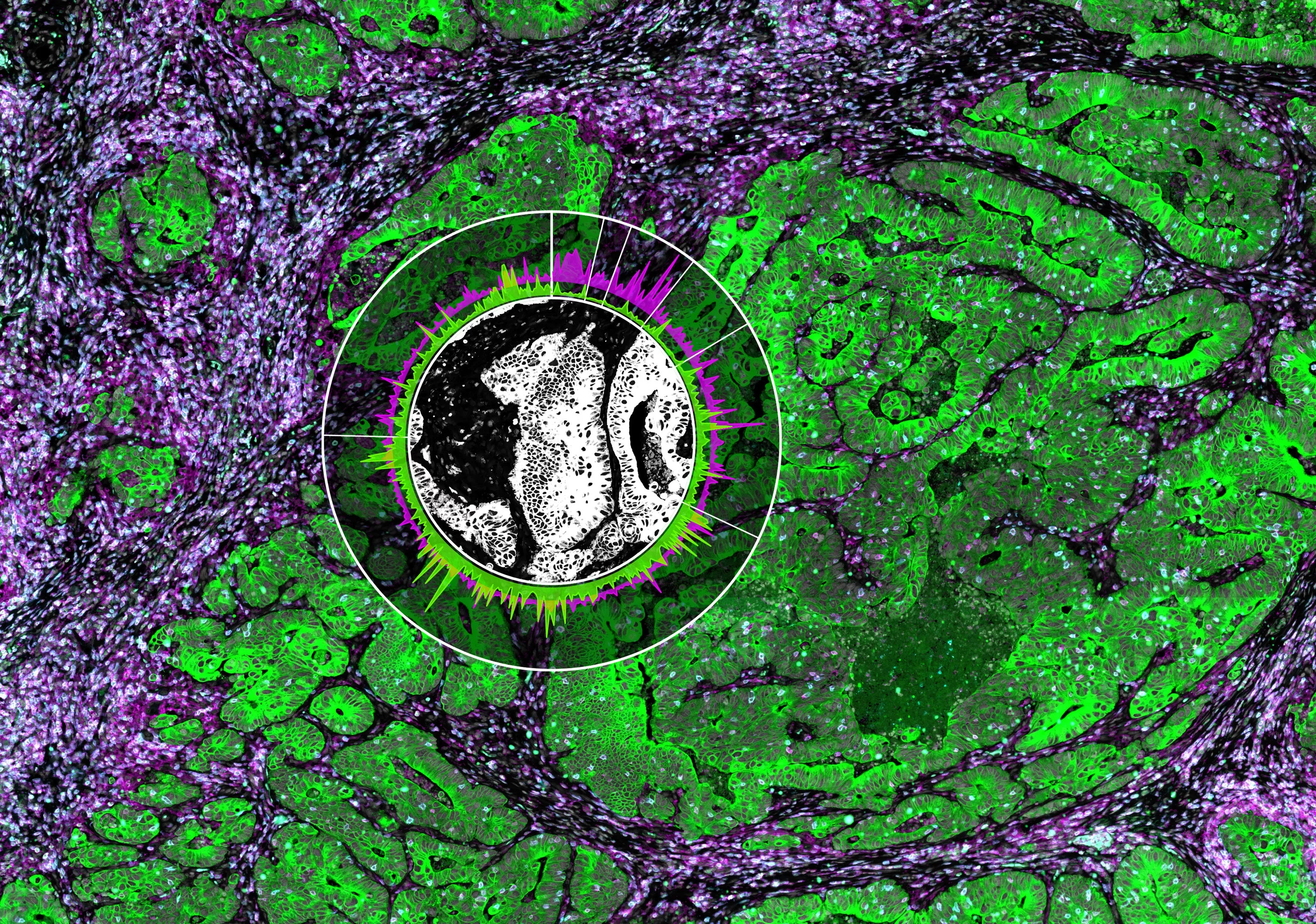
Наконец, они проверили клиническую значимость этого открытия, проанализировав раковые ткани из нескольких органов четырех пациентов с меланомой 4 стадии. Этим пациентам было проведено хирургическое удаление первичных и метастатических лимфатических узлов. Исследователи обнаружили, что у всех четырех пациентов образования типа "клетка в клетке" были очень многочисленны в Т-клеточной зоне дренирующих лимфатических узлов, но не в первичных опухолях. Более того, у пациента с нелеченной рецидивирующей меланомой большинство клеток в первичной опухоли были одиночными, в то время как в рецидивирующих опухолях наблюдалось большое количество образований "клетка в клетке".
"Этот ранее неизвестный механизм резистентности опухоли подчеркивает текущее ограничение иммунотерапии. За последнее десятилетие во многих клинических исследованиях использовалась иммунотерапия с последующей химиотерапией. Но наши результаты показывают, что своевременное ингибирование соответствующих сигнальных путей должно происходить параллельно с иммунотерапией, чтобы предотвратить резистентность опухоли к последующему лечению", - отметил Гутвиллиг.
Gutwillig, A., et al. Транзиторное образование "клетка в клетке" лежит в основе рецидива опухоли и устойчивости к иммунотерапии (аннотация).
Несмотря на замечательные успехи иммунотерапии рака, у большинства пациентов наблюдается лишь частичный ответ, за которым следует рецидив резистентных опухолей. Хотя устойчивость к лечению часто приписывают клональной селекции и иммуноредактированию, сравнение парных первичных и рецидивных опухолей в меланоме и раке молочной железы показывает, что они имеют большинство общих клонов.
В данном исследовании мы продемонстрировали на мышиных моделях и клинических образцах человека, что опухолевые клетки уклоняются от иммунотерапии, создавая уникальные транзиторные структуры "клетка в клетке", которые устойчивы к уничтожению Т-клетками и химиотерапевтическим препаратам. В то время как внешние клетки в этом образовании "клетка в клетке" часто уничтожаются реактивными Т-клетками, внутренние клетки остаются неповрежденными и диссеминируют в отдельные опухолевые клетки, когда Т-клетки больше не присутствуют. Это образование опосредуется преимущественно активированными IFNγ Т-клетками, которые впоследствии вызывают фосфорилирование транскрипционных факторов трансдуктора сигнала и активатора транскрипции 3 (STAT3) и раннего ответа роста-1 (EGR-1) в опухолевых клетках. Действительно, ингибирование этих факторов до начала иммунотерапии значительно повышает ее терапевтическую эффективность.
В целом, эта работа подчеркивает непреодолимое в настоящее время ограничение иммунотерапии и раскрывает ранее неизвестный механизм резистентности, который позволяет опухолевым клеткам выживать после иммуноопосредованного уничтожения без изменения их иммуногенности.