Ученые из Детской исследовательской больницы Святого Иуды разгадали одну из загадок иммунологии.
После деления CD8+ Т-клетки могут образоваться две функционально разные дочерние клетки, несмотря на то, что клетки генетически идентичны. Исследователи объяснили, как это происходит, раскрыв один из механизмов, используемых иммунной системой для обеспечения незамедлительной и долгосрочной защиты. Результаты исследования опубликованы в журнале Molecular Cell.
Авторы показали, как специфический белковый комплекс направляет трансляцию важного иммунного фактора транскрипции в определенной области родительской Т-клетки. Когда клетка делится, поскольку фактор транскрипции находится только в одном регионе, он наследуется асимметрично в двух дочерних клетках. Фактор транскрипции стимулирует экспрессию ряда генов в одной дочерней клетке, подталкивая ее к превращению в эффекторную клетку, в то время как другая становится клеткой памяти.
"Наши результаты указывают на то, что события, происходящие на ранних этапах жизни Т-клетки, могут повлиять на ее функционирование гораздо позже", - говорит соавтор исследования Дуг Грин. "Мы раскрыли один из способов, с помощью которого иммунная система гарантирует, что при активации Т-клеток ответ будет разнообразным: эффекторные клетки начнут стремительную атаку на захватчика, а другие останутся в резерве на потом, в качестве клеток памяти".
Иммунная система имеет множество различных типов клеток с разнообразными функциями. Одним из основных типов клеток являются Т-клетки CD8+. Эти клетки отвечают за непосредственное уничтожение инфицированных и опухолевых клеток. Они активируются специальной клеткой, на поверхности которой находится фрагмент вируса или опухолевой клетки - антиген. Место контакта между Т-клетками и антигенпрезентирующими клетками называется иммунным синапсом. После активации Т-клетки делятся на генетически идентичные дочерние клетки. Многие из дочерних клеток становятся эффекторными клетками, которые также уничтожают инфицированные или раковые клетки. Однако некоторые из дочерних клеток становятся клетками памяти, которые обеспечивают защиту от будущих инфекций или того же рака. До этого исследования было не ясно, как от одной и той же родительской Т-клетки могут произойти и эффекторные клетки, и клетки памяти.
В качестве первого ключа к разгадке группа Грина ранее показала, что первые две дочерние клетки от родительской активированной Т-клетки имеют разный уровень белка c-Myc. Это важно, поскольку c-Myc является транскрипционным фактором, известным тем, что он управляет экспрессией генов, которые заставляют Т-клетки становиться эффекторными клетками. Однако c-Myc нестабилен, половина всего c-Myc в клетке исчезает в течение 20 минут. Как же c-Myc может присутствовать достаточно долго и в правильном положении, чтобы преимущественно попасть в одну дочернюю клетку?
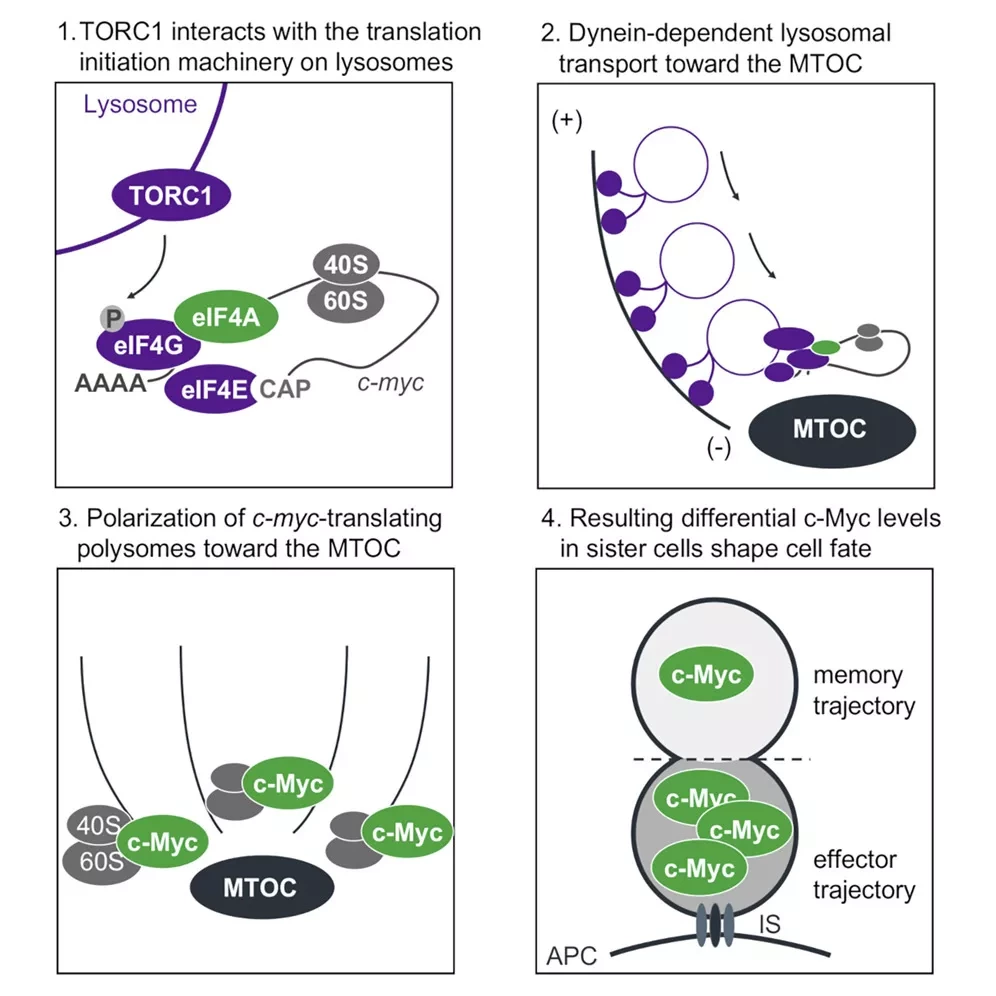
Как правило, ответ связан с мРНК. мРНК служит шаблоном, который клетки используют для создания белка. Когда нестабильный белок концентрируется в одной части клетки, это происходит потому, что его шаблон мРНК ограничен этим местом. Однако транскрипты мРНК c-myc были равномерно распределены по всей клетке. Вместо этого исследователи обнаружили, что белковый комплекс, создающий c-Myc, присутствует только вблизи иммунного синапса. Специфический комплекс, ответственный за перевод c-Myc, называется эукариотическим комплексом фактора инициации трансляции 4F (eIF4F). Комплекс eIF4F - это механизм трансляции, который принимает сообщения мРНК и превращает их в белки, в данном случае в c-Myc. мРНК c-myc имеет сложную структуру на одном конце. Только комплекс eIF4F может использовать сложную структуру мРНК c-myc для запуска процесса трансляции в белок. Поэтому c-Myc вырабатывается только там, где присутствует eIF4F, что отбрасывает c-Myc на одну сторону клетки.
Впервые расположение механизмов трансляции было описано как причина того, что белок присутствует только в одной части клетки. Хотя расположение eIF4F объясняет, почему c-Myc находится только в одной части клетки, оно раскрывает новую загадку: как eIF4F оказался сосредоточенным на одном конце клетки?
Ученые использовали специальную технику микроскопии, называемую микроскопией экспансии, чтобы "взорвать" Т-клетку и узнать, как eIF4F перемещается по клетке. Это примерно эквивалентно увеличению мыши до размеров слона. В данном исследовании эта техника впервые была использована на первичных Т-клетках. Группа Грина увидела, как eIF4F перемещается по клетке к одному из концов иммунного синапса, включая механизмы перемещения и конечное размещение eIF4F на молекулярной "платформе", связанной с синапсом.
Группа Грина проверила, что пары "сестринских" клеток - дочерних клеток от одного родителя - начинали экспрессировать гены двух разных линий, эффекторной или памяти. Группа использовала систему генетического "штрих-кода", чтобы отследить, какие отдельные клетки являются родственными. Это было чрезвычайно сложной технической задачей, поскольку за пределами перестроенной последовательности штрих-кода было много клеток, которые были генетически идентичны. Но группа смогла определить последовательность транскриптов мРНК этих клеток. Транскрипты показали, что генетически идентичные сестринские клетки с одинаковыми штрих-кодами экспрессируют различные гены, которые, как известно, связаны с соответствующим подтипом Т-клеток.
"Это исследование - первый случай, когда мы можем с уверенностью сказать, что две сестринские клетки могут иметь совершенно разные паттерны экспрессии генов", - сказал Грин.
"Исследование также демонстрирует, что существуют основные принципы клеточной архитектуры, которые создают платформы, на которых могут локализоваться внутриклеточные события. При делении асимметрия в распределении этих платформ может привести к диверсификации судьбы клеток. Детали могут быть иными для других типов клеток, но принципы, скорее всего, сохранятся".
Swantje Liedmann et al. Локализация комплекса трансляции TORC1-eIF4F во время активации CD8+ Т-клеток управляет дивергентной судьбой клеток (аннотация).
Активированные CD8+ Т-лимфоциты дифференцируются в гетерогенные субпопуляции. Используя сверхразрешающую визуализацию, мы обнаружили, что перед первым делением динеин-зависимый везикулярный транспорт поляризует активный TORC1 в направлении микротрубочек-организующего центра (MTOC) на проксимальном полюсе. Этот активный TORC1 был физически связан с активным eIF4F, необходимым для трансляции мРНК c-myc. Как следствие, c-myc-транслирующие полисомы поляризовались в направлении клеточного полюса, проксимального к иммунному синапсу, что приводило к локализации трансляции c-myc. При делении комплекс TORC1-eIF4A преимущественно перемещался в проксимальную дочернюю клетку, способствуя асимметричному синтезу c-Myc. Преходящее нарушение активности eIF4A при первом делении искажало долгосрочные траектории клеточной судьбы в сторону функции, аналогичной памяти. Используя метод генетического кодирования, мы обнаружили, что сестринские клетки первого деления часто демонстрируют различия в транскрипционных профилях, которые в основном коррелируют с генами-мишенями c-Myc и TORC1.
Наши результаты дают представление о том, как различные траектории судьбы Т-клеток могут быть сформированы во время первого деления.