Ученые из Университета Хоккайдо обнаружили новый защитный механизм против SARS-CoV-2, в котором участвует рецептор распознавания вирусных паттернов RIG-I. Повышение экспрессии этого белка может усилить иммунный ответ у пациентов с ХОБЛ.
За 18 месяцев, прошедших с момента первого сообщения о COVID-19 и распространения пандемии, было проведено большое количество исследований, направленных на понимание этого заболевания и разработку методов его лечения. COVID-19 поражает не всех инфицированных одинаково. У многих людей заболевание протекает бессимптомно; из тех, у кого есть симптомы, у подавляющего большинства они слабо выражены, и лишь у небольшого числа - тяжелые. Причины этого не до конца понятны и являются важной областью продолжающихся исследований.
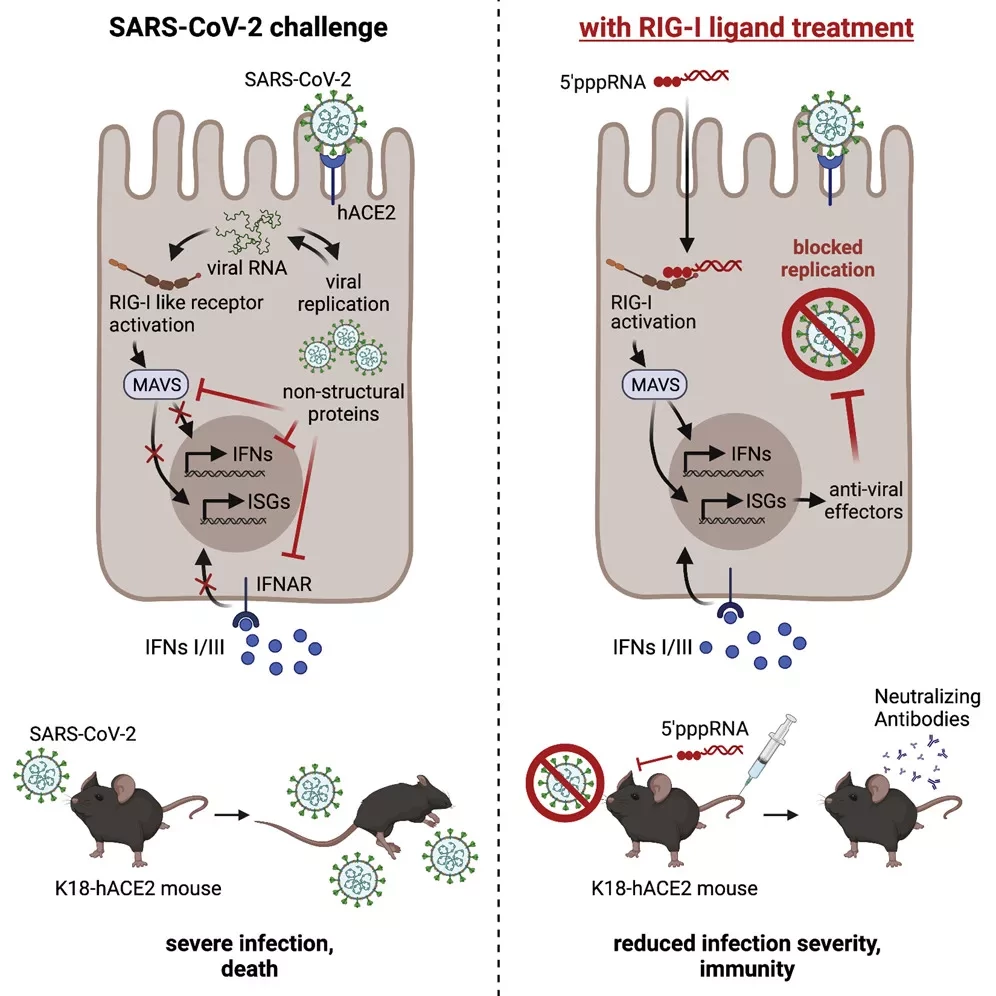
Группа ученых из Университета Хоккайдо под руководством профессора Акинори Такаока из Института генетической медицины показала, что RIG-I, биологическая молекула, обнаруживающая РНК-вирусы, сдерживает репликацию SARS-CoV-2 в клетках легких человека. Результаты исследования, которые могут помочь в прогнозировании исхода COVID-19, опубликованы в журнале Nature Immunology.
На сегодняшний день COVID-19 поразил более 162 миллионов человек. Около 40% - 45% случаев протекают бессимптомно; что касается остальных, то примерно у 35% - 40% наблюдалась легкая форма заболевания, а у остальных 19% симптомы были настолько тяжелыми, что требовали госпитализации или приводили к летальному исходу, что обычно связано с сопутствующими заболеваниями и факторами риска, такими как хроническая обструктивная болезнь легких (ХОБЛ). Такой диапазон симптомов указывает на то, что существуют значительные различия между индивидуальными реакциями на вирус.
Микробные патогены в нашем организме обнаруживаются белками, называемыми рецепторами распознавания паттернов (PRR), которые также вызывают иммунный ответ на эти патогены. Вирусные инфекции распознаются субпопуляцией PRRs; ученые сосредоточили свое внимание на белке RIG-I, который принадлежит к этой субпопуляции. Известно, что RIG-I имеет решающее значение для обнаружения и ответа на РНК-вирусы, такие как вирус гриппа.
В экспериментах, проведенных на клеточных культурах, ученые обнаружили, что в легочных клетках врожденный иммунный ответ на SARS-CoV-2 был незначительным, что говорит о том, что сигнальный путь, ведущий к иммунному ответу, был прерван. Тем не менее, вирусная репликация была подавлена. Ученые исследовали роль RIG-I и обнаружили, что его дефицит вызывает усиление вирусной репликации. Дальнейшие эксперименты подтвердили, что подавление вирусной репликации зависит от RIG-I.
В одном предыдущем исследовании было показано, что экспрессия RIG-I снижена в легочных клетках пациентов с ХОБЛ. Используя первичные легочные клетки двух пациентов с ХОБЛ, ученые показали, что это снижение экспрессии RIG-I привело к обнаружению вирусной репликации через 5 дней. Они также продемонстрировали, что воздействие на эти клетки ХОБЛ транс-ретиноевой кислоты (ATRA), которая повышает экспрессию RIG-I, значительно снижает титры вирусов в клетках.
Кроме того, используя мутанты RIG-I, они смогли выяснить механизмы, с помощью которых RIG-I подавляет репликацию SARS-CoV-2: домен геликазы, структурный элемент RIG-I, взаимодействует с вирусной РНК, блокирует фермент вируса, ответственный за репликацию.
Данное исследование продемонстрировало уникальный механизм распознавания вирусов RIG-I, названный RIG-I-опосредованным сигнально-абортивным защитным механизмом против вируса SARS-CoV-2.
Оно также показало, что уровень экспрессии RIG-I является одним из потенциальных параметров для прогнозирования исхода заболевания у пациентов с COVID-19. Необходимо продолжить работу по выявлению факторов или условий, которые модулируют уровень экспрессии RIG-I, что может привести к новым стратегиям борьбы с инфекцией SARS-CoV-2.
Taisho Yamada et al. RIG-I запускает сигнально-абортивную защиту против SARS-CoV-2 в клетках легких человека (аннотация).
Эффективный иммунный ответ против вирусной инфекции определяется достаточной активацией сенсоров нуклеиновых кислот, опосредованных врожденным иммунитетом. Коронавирусная болезнь 2019 года, вызванная коронавирусом 2 тяжелого острого респираторного синдрома (SARS-CoV-2), остается продолжающейся глобальной пандемией. Актуальной задачей является выяснение механизма врожденного распознавания для борьбы с этим вирусом. В данном исследовании мы показали, что ген-I, индуцируемый ретиноевой кислотой (RIG-I), в достаточной степени сдерживает репликацию SARS-CoV-2 в клетках легких человека в независимой от интерферона I/III типа (IFN) манере.
RIG-I распознает 3′ нетранслируемую область генома РНК SARS-CoV-2 через домены хеликаз, но не через С-концевой домен. Этот новый способ распознавания RIG-I не стимулирует его АТФазу, тем самым отменяя активацию обычных митохондриальных противовирусных сигнальных белок-зависимых путей, что соответствует отсутствию индукции цитокинов. Тем не менее, взаимодействие RIG-I с вирусным геномом напрямую прерывает посредничество вирусной РНК-зависимой РНК-полимеразы на первом этапе репликации.
Соответственно, генетическая блокада RIG-I позволяет легочным клеткам производить вирусные частицы, экспрессирующие белок вирусного шипа. В противоположность этому, анти-SARS-CoV-2 активность восстанавливалась при лечении ретиноевой кислотой в полном объеме за счет повышения экспрессии белка RIG-I в первичных легочных клетках, полученных от пациентов с хронической обструктивной болезнью легких.
Таким образом, наши результаты свидетельствуют об особой роли RIG-I как сдерживающего фактора на ранней стадии инфекции SARS-CoV-2 в клетках легких человека.